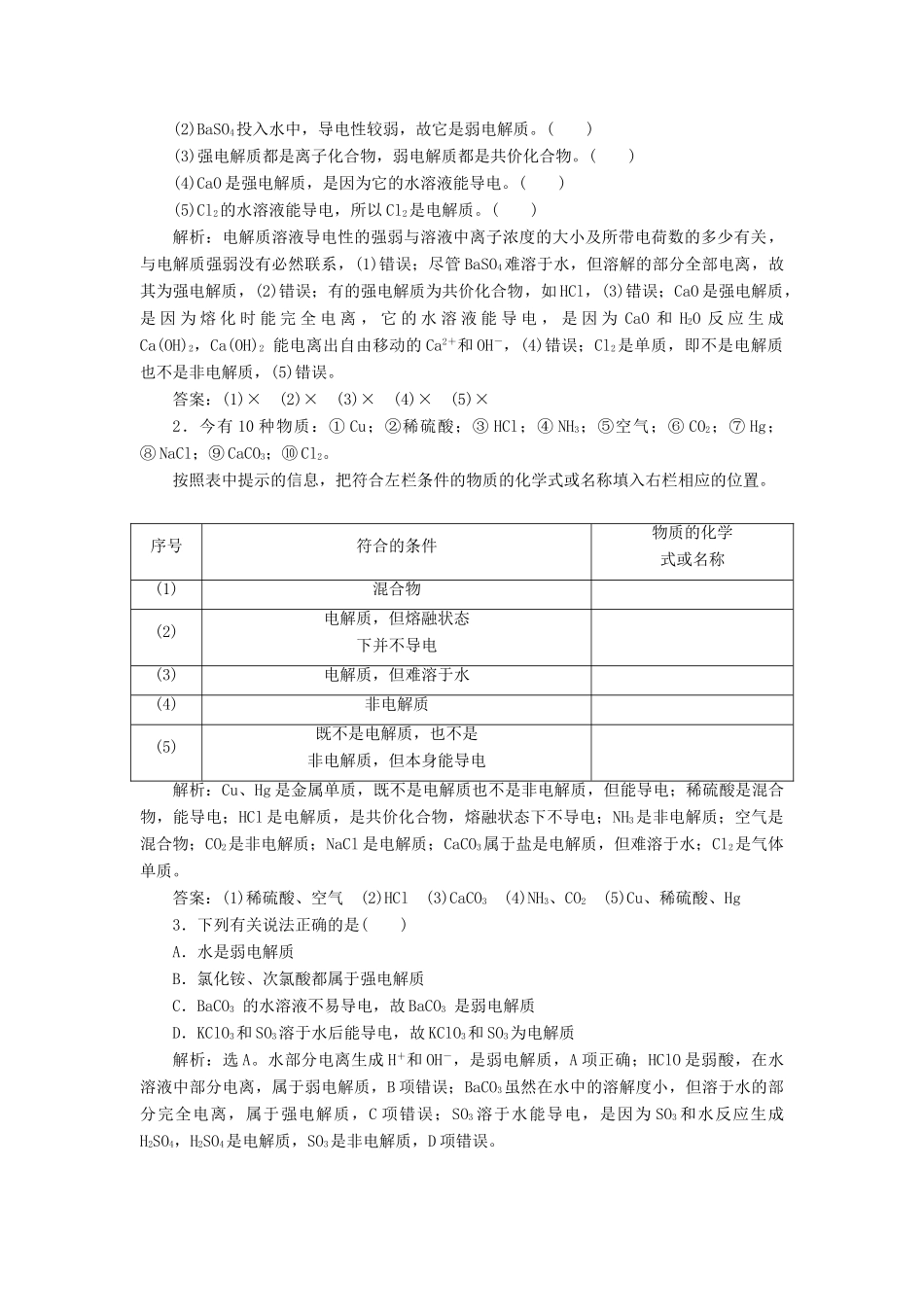
第二单元 离子反应学习任务 1 电解质及其电离一、从电解质的角度对化合物分类1.分类依据2.电解质的强弱与物质类别的关系 强酸、强碱、绝大多数盐,如 HNO3、NaOH、CaCO3等 弱酸、弱碱和水,如乙酸、一水合氨等二、电离及电离方程式1.电解质的电离电离指电解质在水溶液中或熔融状态下产生自由移动离子的过程。2.电离方程式的书写(1)强电解质的电离方程式中,用“===”连接,弱电解质(包括弱酸的酸式酸根)的电离方程式中,用“”连接。如 Na2SO4:Na2SO4===2Na++SO;HClO:HClOH++ClO-。(2)多元弱酸的电离分步书写,多元弱碱的电离一步写完。如 H2CO3:H2CO3 H + + HCO、HCO H + + CO __;Fe(OH)3:Fe(OH)3 Fe 3 + + 3OH - 。(3)酸式盐的电离:多元强酸酸式盐与多元弱酸酸式盐的阴离子电离情况不同。如 NaHSO4溶液中:NaHSO4== =Na + + H + + SO __;NaHCO3溶液中:NaHCO3== =Na + + HCO __、HCOH++CO。1.判断正误,正确的打“√”,错误的打“×”。(1)强电解质溶液的导电性一定比弱电解质溶液的导电性强。( )(2)BaSO4投入水中,导电性较弱,故它是弱电解质。( )(3)强电解质都是离子化合物,弱电解质都是共价化合物。( )(4)CaO 是强电解质,是因为它的水溶液能导电。( )(5)Cl2的水溶液能导电,所以 Cl2是电解质。( )解析:电解质溶液导电性的强弱与溶液中离子浓度的大小及所带电荷数的多少有关,与电解质强弱没有必然联系,(1)错误;尽管 BaSO4难溶于水,但溶解的部分全部电离,故其为强电解质,(2)错误;有的强电解质为共价化合物,如 HCl,(3)错误;CaO 是强电解质,是 因 为 熔 化 时 能 完 全 电 离 , 它 的 水 溶 液 能 导 电 , 是 因 为 CaO 和 H2O 反 应 生 成Ca(OH)2,Ca(OH)2 能电离出自由移动的 Ca2+和 OH-,(4)错误;Cl2是单质,即不是电解质也不是非电解质,(5)错误。答案:(1)× (2)× (3)× (4)× (5)×2.今有 10 种物质:① Cu;②稀硫酸;③ HCl;④ NH3;⑤空气;⑥ CO2;⑦ Hg;⑧ NaCl;⑨ CaCO3;⑩ Cl2。按照表中提示的信息,把符合左栏条件的物质的化学式或名称填入右栏相应的位置。序号符合的条件物质的化学式或名称(1)混合物(2)电解质,但熔融状态下并不导电(3)电解质,但难溶于水(4)非电解质(5)既不是电解质,也不是非电解质,但本身能导电解析:Cu、Hg 是金...