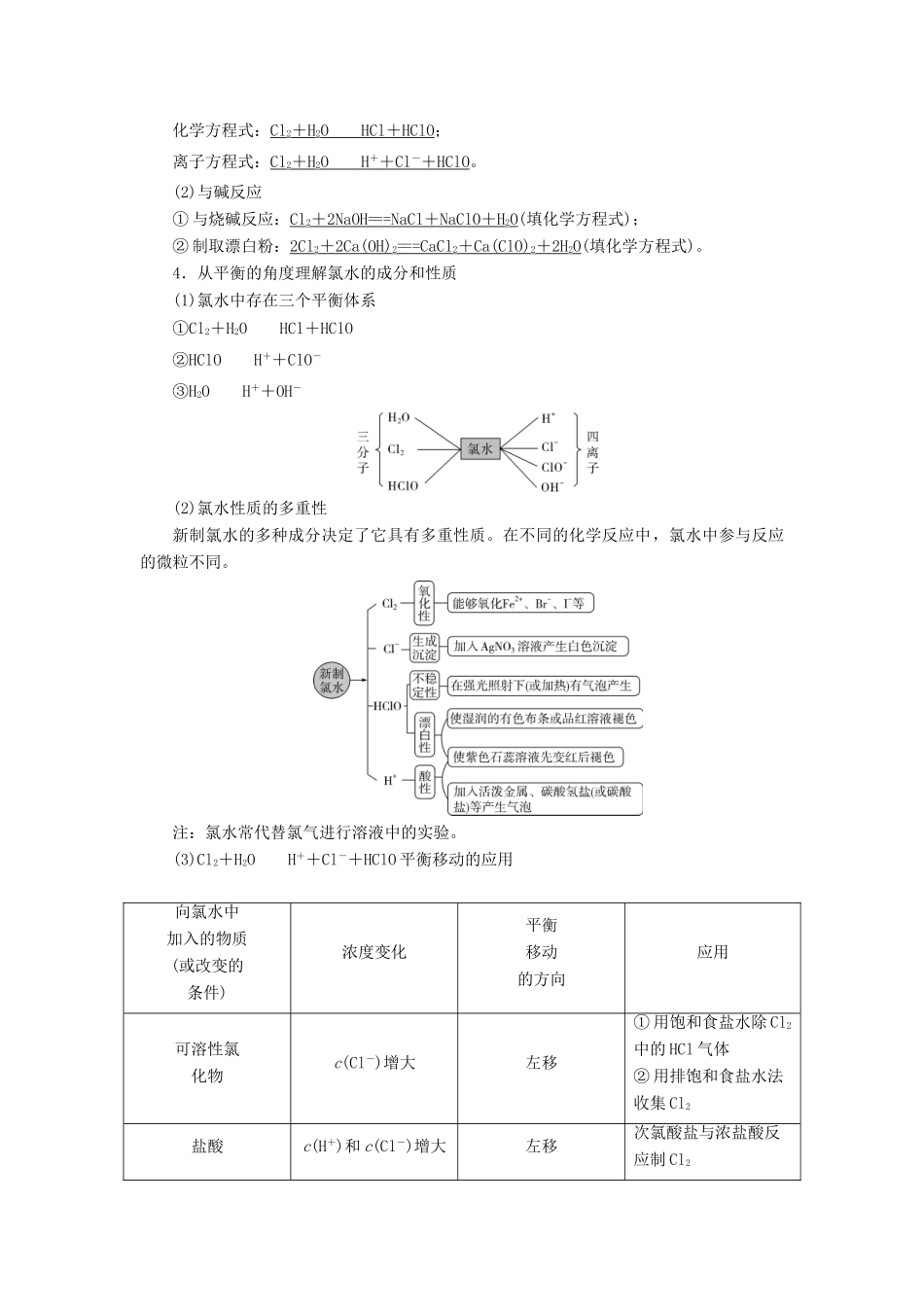
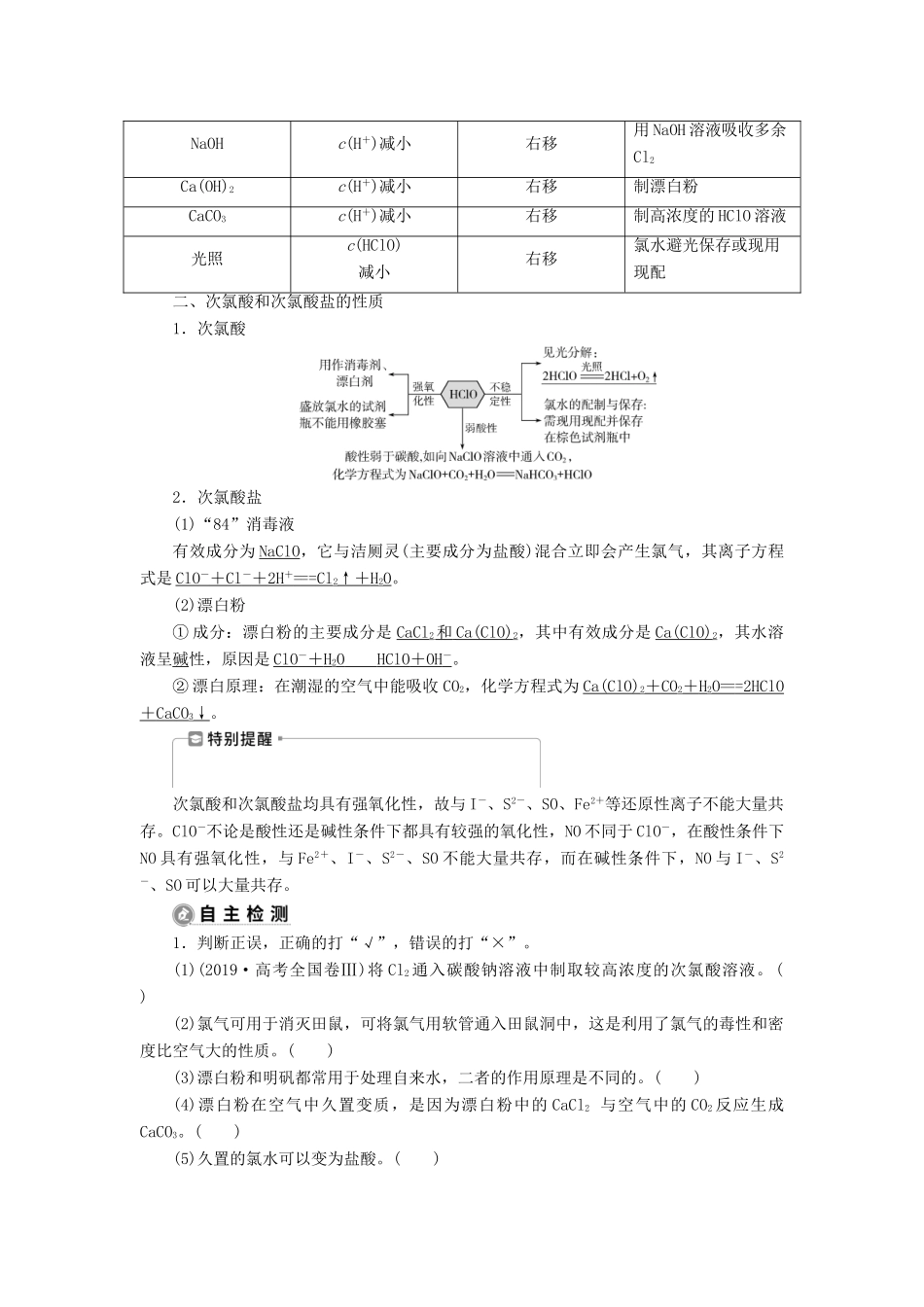
第三单元 氯、溴、碘及其重要化合物学习任务 1 氯及其重要化合物的性质与应用一、氯气的性质1.氯气的物理性质颜色状态气味密度毒性溶解性特性黄绿色气体有刺激性气味比空气大有毒能溶于水,1 体积水约溶解 2体积 Cl2易液化2.从氯原子的原子结构认识氯气的化学性质——氧化性依据氯气的氧化性完成下列方程式:(1)与金属反应①Fe:2Fe + 3Cl 2===== 2FeCl 3,棕红色烟。②Cu:Cu + Cl 2===== CuCl 2,棕黄色烟。(2)与非金属反应H2:H2+ Cl 2===== 2HCl ,苍白色火焰;H2和 Cl2的混合气体光照时会发生爆炸。(3)与还原性无机化合物反应① 与碘化钾溶液反应:Cl2+ 2I - == =2Cl - + I 2(填离子方程式)。② 与 SO2水溶液反应:Cl2+ SO 2+ 2H 2O == =H 2SO4+ 2HCl 、 Cl 2+ SO 2+ 2H 2O == =4H + + SO + 2Cl -(填化学方程式和离子方程式)。③ 与 FeCl2溶液反应:Cl2+ 2Fe 2 + == =2Fe 3 + + 2Cl - (填离子方程式)。3.从化合价的角度认识氯气的化学性质——歧化反应氯气与水或碱反应,氯元素的化合价既有升高又有降低,因而氯气既表现氧化性又表现还原性。(1)与水反应化学方程式:Cl2+ H 2O HCl + HClO ;离子方程式:Cl2+ H 2O H + + Cl - + HClO 。(2)与碱反应① 与烧碱反应:Cl2+ 2NaOH == =NaCl + NaClO + H 2O(填化学方程式);② 制取漂白粉:2Cl2+ 2Ca(OH) 2== =CaCl 2+ Ca(ClO) 2+ 2H 2O(填化学方程式)。4.从平衡的角度理解氯水的成分和性质(1)氯水中存在三个平衡体系①Cl2+H2OHCl+HClO②HClOH++ClO-③H2OH++OH-(2)氯水性质的多重性新制氯水的多种成分决定了它具有多重性质。在不同的化学反应中,氯水中参与反应的微粒不同。注:氯水常代替氯气进行溶液中的实验。(3)Cl2+H2OH++Cl-+HClO 平衡移动的应用向氯水中加入的物质(或改变的条件)浓度变化平衡移动的方向应用可溶性氯化物c(Cl-)增大左移① 用饱和食盐水除 Cl2中的 HCl 气体② 用排饱和食盐水法收集 Cl2盐酸c(H+)和 c(Cl-)增大左移次氯酸盐与浓盐酸反应制 Cl2NaOHc(H+)减小右移用 NaOH 溶液吸收多余Cl2Ca(OH)2c(H+)减小右移制漂白粉CaCO3c(H+)减小右移制高浓度的 HClO 溶液光照c(HClO)减小右移氯水避光保存或现用现配二、次氯酸和次氯酸盐的性质1.次氯酸2.次氯酸盐(1)“84”消毒...