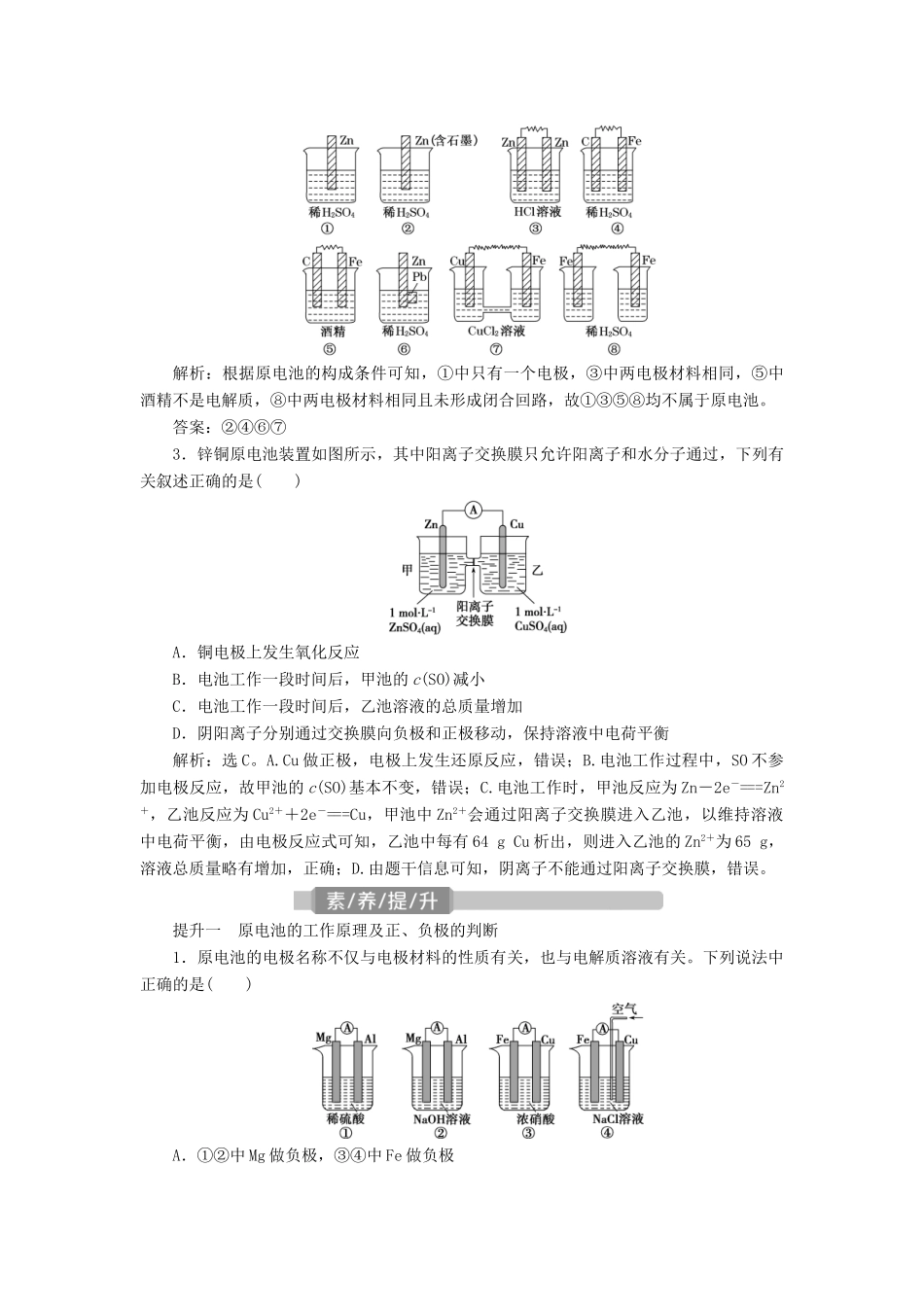
第二单元 原电池 化学电源学习任务 1 原电池及其工作原理1.概念把化学能转化为电能的装置。2.构成条件(1)一看反应:看是否有能自发进行的氧化还原反应发生。(2)二看两电极:一般是活泼性不同的两电极。(3)三看是否形成闭合回路形成闭合回路需三个条件:①电解质溶液;②两电极直接或间接接触;③两电极插入电解质溶液。3.工作原理(以铜锌原电池为例)电极名称负极正极电极材料ZnCu电极反应Zn - 2e - == =Zn 2 + Cu 2 + + 2e - == =Cu 反应类型氧化反应还原反应电子流向(外电路)由负极沿导线流向正极离子流向(内电路)阴离子向负极移动,阳离子向正极移动;盐桥(含饱和 KCl溶液)中离子流向:K+移向正极,Cl-移向负极电池反应(离子方程式)Zn+Cu2+===Zn2++Cu两类装置的不同点装置Ⅰ:还原剂 Zn 与氧化剂 Cu2+直接接触,化学能既转化为电能,又转化为热能,造成能量损耗装置Ⅱ:还原剂 Zn 与氧化剂 Cu2+不直接接触,化学能仅转化为电能,避免能量损耗,故电流稳定,持续时间长(1)盐桥原电池中半电池的构成条件:电极金属和其对应的盐溶液。一般不要任意替换成其他阳离子盐溶液,否则可能影响效果。盐桥中装有饱和的 KCl、KNO3等溶液和琼胶制成的胶冻。(2)盐桥的作用,① 连接内电路,形成闭合回路;② 平衡电荷,使原电池不断产生电流。4.原电池原理的应用(1)比较金属的活动性强弱原电池中,一般活动性强的金属做负极,而活动性弱的金属(或非金属)做正极。(2)加快化学反应速率一个自发进行的氧化还原反应,设计成原电池时反应速率增大,如 Zn 与稀硫酸反应制氢气时,可向溶液中滴加少量 CuSO4溶液,形成 CuZn 原电池,加快反应的进行。(3)用于金属的防护使需要保护的金属制品做原电池正极而受到保护,如要保护一个铁质的输水管道或钢铁桥梁,可用导线将其与一块锌块相连,使锌做原电池的负极。(4)设计制作化学电源① 首先将氧化还原反应分成两个半反应。② 根据原电池的反应特点,结合两个半反应找出正、负极材料和电解质溶液。1.判断正误,正确的打“√”,错误的打“×”。(1)理论上说,任何自发的氧化还原反应都可设计成原电池。( )(2)在原电池中,发生氧化反应的一极一定是负极。( )(3)用 Mg、Al 分别做电极,用 NaOH 溶液做电解质溶液,构成原电池,Mg 为正极。( )(4)在锌铜原电池中,因为有电子通过电解质溶液形成闭合回路,所以有电流产生。( )(5)原电池工作时,溶液中的阳...