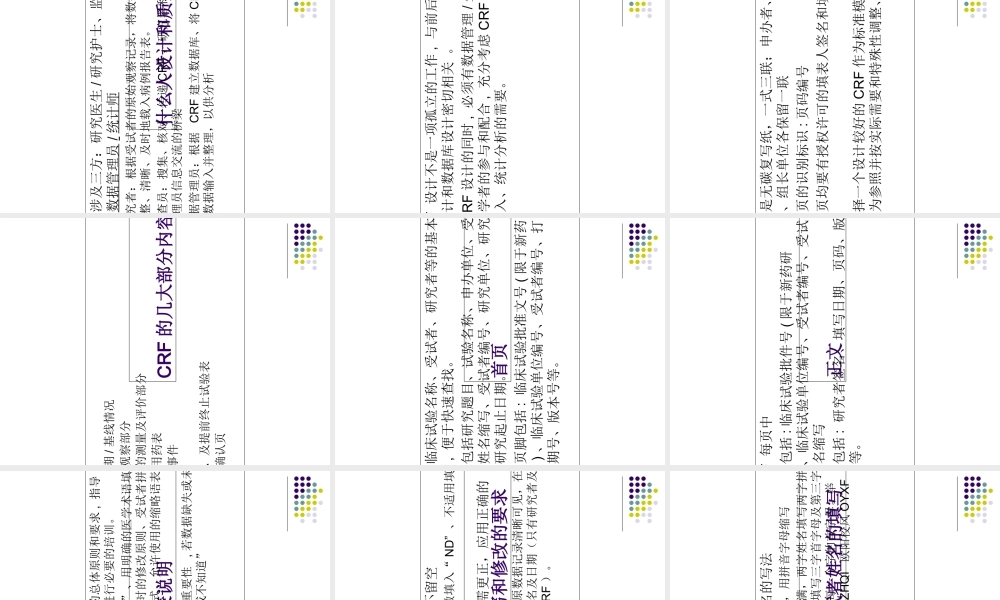
CRF 设计专题知识讲座什么是病例报告表 病例报告表( Case Report Form, CRF ),指按试验方案所规定设计的一种文件,用以记录每一名受试者在试验过程中的数据——中国2003 《药物临床试验质量管理规范》 GCP 一种印刷的、可视的或者是电子版的文件 , 用于记录并向申办者报告每个受试者的所有试验方案要求的信息——人用药品注册技术国际协调组织 (ICH) 的 GCP病例报告表 (CRF) 的功能 是临床试验中获取研究资料的重要手段,是收集数据的工具,是收集、记录和保存临床试验资料的载体 记录了试验方案中对受试者要求的所有信息 ,是研究方案( protocol )的准确体现 方便记录和计算机整理、分析,是该研究统计 、总结、报批的重要依据 , 是今后申办者和临床研究人员惟一能够有权保留的试验数据资料CRF 设计的重要性 临床研究的过程就是临床研究人员完成 CRF 的过程 ,如果所有的数据填写经核查合格 , 进入统计阶段 , 这试验就基本结束了。 至于这一新药是否有效或这新的治疗方法是否有效 ,完全由试验数据来决定 。 但如果 CRF 设计不合理、填写混乱 , 各种数据无法统计 , 即使是个好药或一个十分漂亮的试验方案 ,也不能得出科学、可靠的结论来 , 这样不仅使一个好药失去了上市的机会 , 还浪费了很多资源和人力物力 。 正确设计 CRF 是保证收集的资料是否完整准确和临床试验质量的重要内容之一 各个国家包括 国际组织对 CRF 在设计形式上没有一致的要求 , 但总的原则是一致的 ,即要符合临床研究的各种需要CRF 的设计原则(一) 完全遵循临床试验方案 在临床研究中尽管方案设计得很完善 , 但若 CRF 设计不严谨 , 也将影响统计数据的完整与可靠 , 进而影响研究结论的可靠性和准确性 , 如主要数据遗漏,将造成难以弥补的损失 临床试验方案中涉及的问题必须在 CRF 中体现 , 方案中不关注的信息一定不要出现在 CRF 中 可能非预期的或少见的不良反应,可以记录在“其他 ”部分。 如果方案做出修改 , 且其修改的内容影响到资料的记录 ,CRF 也要做相应的修改CRF 的设计原则(二) 全面完整,简明扼要 GCP 规定 , 在统计分析中发现有遗漏 、未用或多余的数据要加以说明 , 所以 CRF 中不应收集和该项研究无关 的数据 。否则应注明理由 只包括与研究目的有关的信息 , 避免收集不必要的信息,减少重复和交互检查...