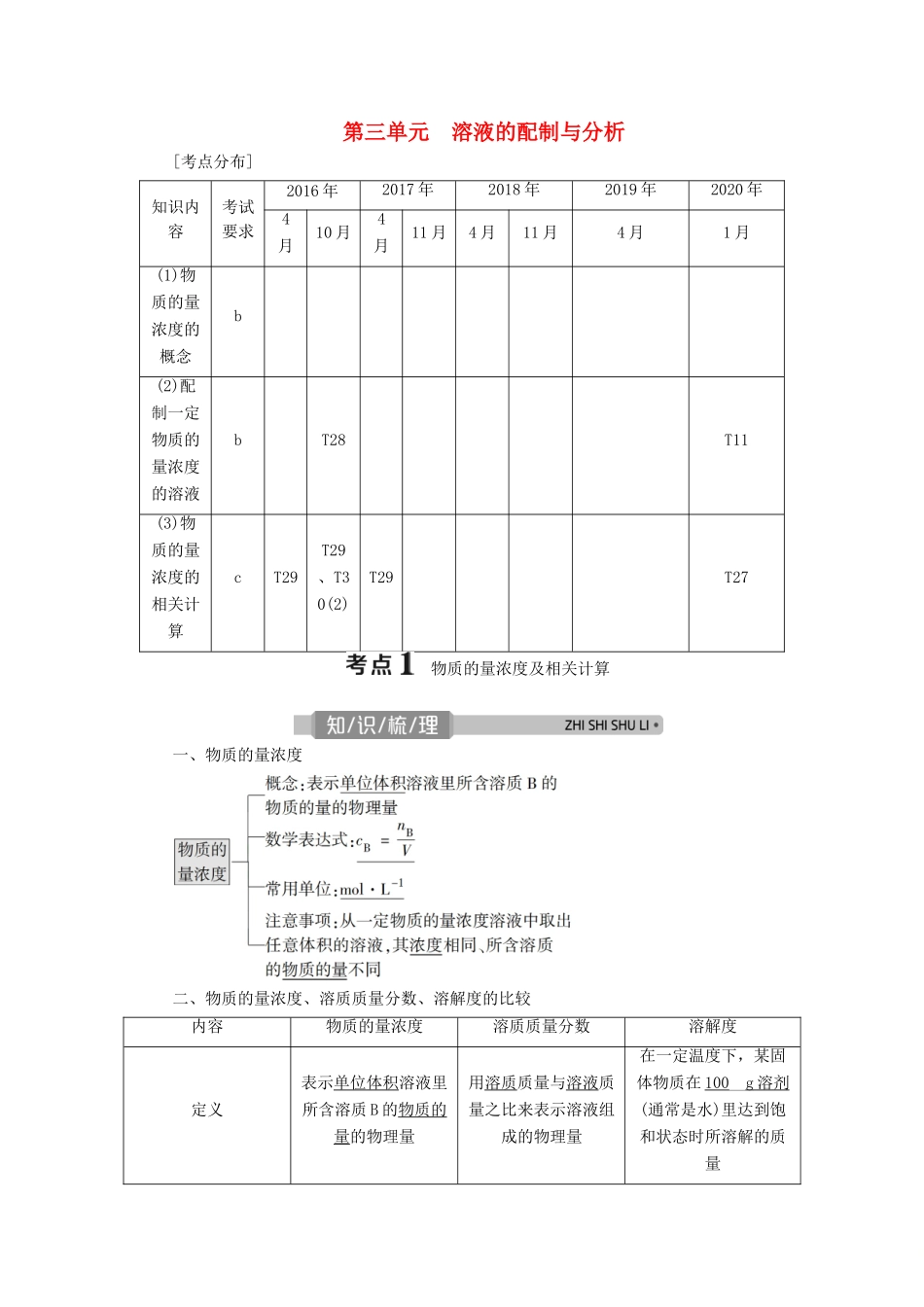
第三单元 溶液的配制与分析[考点分布]知识内容考试要求2016 年2017 年2018 年2019 年2020 年4月10 月4月11 月4 月11 月4 月1 月(1)物质的量浓度的概念b(2)配制一定物质的量浓度的溶液bT28T11(3)物质的量浓度的相关计算cT29T29、T30(2)T29T27 物质的量浓度及相关计算一、物质的量浓度二、物质的量浓度、溶质质量分数、溶解度的比较内容物质的量浓度溶质质量分数溶解度定义表示单位体积溶液里所含溶质 B 的物质的量的物理量用溶质质量与溶液质量之比来表示溶液组成的物理量在一定温度下,某固体物质在 100__g 溶剂 (通常是水)里达到饱和状态时所溶解的质量单位mol·L-1—g计算公式c=w=×100%S=×100 g (1)c=中的 V 是溶液的体积,不是溶剂的体积,也不是溶质和溶剂的体积之和。(2)将 CuSO4·5H2O 晶体溶于水,其溶质是 CuSO4。将 Na、Na2O、Na2O2溶于水,其溶质是 NaOH;将 SO3溶于水,所得溶质是 H2SO4。(3)配制一定溶质质量分数的溶液,所选烧杯的规格一般应大于溶液体积的一倍。(4)在溶解度的概念中,“100”指的是 100 g 溶剂(通常是 H2O),而不是溶液。三、有关物质的量浓度计算的四大类型类型 1 标准状况下,气体溶液的物质的量浓度的计算 c=类型 2 溶液中溶质的质量分数与物质的量浓度的换算(1)计算公式:c=(c 为溶质的物质的量浓度,单位 mol·L-1,ρ 为溶液密度,单位g·cm-3,w 为溶质的质量分数,M 为溶质的摩尔质量,单位 g·mol-1)。当溶液为饱和溶液时,因为 w=,可得 c=。(2)公式的推导(按溶液体积为 V L 推导)c===或 w===。类型 3 溶液稀释和同种溶质的溶液混合的计算(1)溶液稀释① 溶质的质量在稀释前后保持不变,即 m1w1=m2w2。② 溶质的物质的量在稀释前后保持不变,即 c1V1=c2V2。③ 溶液质量守恒,即 m(稀)=m(浓)+m(水)(体积一般不守恒)。(2)溶液混合① 混合前后溶质的物质的量保持不变,即 c1V1+c2V2=c 混V 混。② 混合前后溶质的质量保持不变,即 m1w1+m2w2=m 混w 混。类型 4 应用电荷守恒式进行未知离子的浓度计算溶液中所有阳离子所带正电荷总数与阴离子所带负电荷总数相等。例如:CH3COONa 和 CH3COOH 的混合溶液中存在c(CH3COO-)+c(OH-)=c(Na+)+c(H+)。题组一根据 cB= 的计算1.(2020·嘉兴第一中学期中)测得 V L Al2(SO4)3溶液中含 m g Al3+,则该溶液中 SO的物质的量浓度是( )A. mol/L B. m...