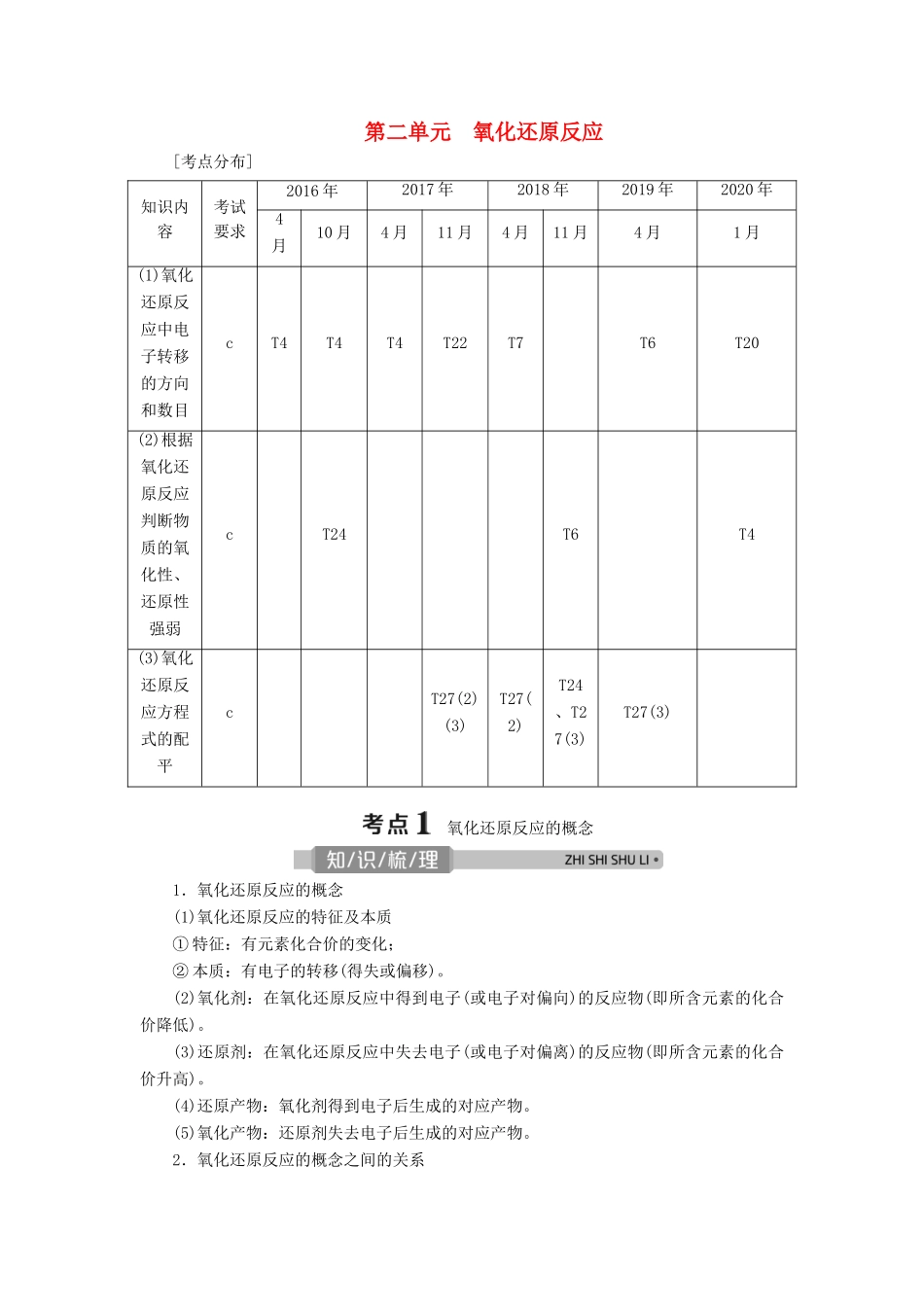
第二单元 氧化还原反应[考点分布]知识内容考试要求2016 年2017 年2018 年2019 年2020 年4月10 月4 月11 月4 月11 月4 月1 月(1)氧化还原反应中电子转移的方向和数目cT4T4T4T22T7T6T20(2)根据氧化还原反应判断物质的氧化性、还原性强弱cT24T6T4(3)氧化还原反应方程式的配平cT27(2)(3)T27(2)T24、T27(3)T27(3) 氧化还原反应的概念1.氧化还原反应的概念(1)氧化还原反应的特征及本质① 特征:有元素化合价的变化;② 本质:有电子的转移(得失或偏移)。(2)氧化剂:在氧化还原反应中得到电子(或电子对偏向)的反应物(即所含元素的化合价降低)。(3)还原剂:在氧化还原反应中失去电子(或电子对偏离)的反应物(即所含元素的化合价升高)。(4)还原产物:氧化剂得到电子后生成的对应产物。(5)氧化产物:还原剂失去电子后生成的对应产物。2.氧化还原反应的概念之间的关系概括为升失氧、降得还,剂性一致、其他相反。3.氧化还原反应中电子转移的表示方法(1)双线桥法表示方法:如 Cu 与浓硝酸反应中电子转移的方向和数目: (2)单线桥法表示方法:如 Cu 与浓硝酸反应中电子转移的方向和数目: 4.常见氧化剂和还原剂(1)常见氧化剂常见氧化剂包括某些非金属单质、含有高价态元素的化合物、过氧化物等。例如:(2)常见还原剂常见还原剂包括活泼的金属单质、非金属离子及低价态化合物、低价金属阳离子、非金属单质及其氢化物等。例如:(3)具有中间价态的物质既有氧化性,又有还原性。例如:具有中间价态的物质氧化产物还原产物Fe2+Fe3+FeSOSOSH2O2O2H2O其中 Fe2+、SO 主要表现还原性,H2O2主要表现氧化性。题组氧化还原反应的基本概念1.(2019·浙江 4 月选考,T6)反应 8NH3+3Cl2===N2+6NH4Cl,被氧化的 NH3与被还原的 Cl2的物质的量之比为( )A.2∶3 B.8∶3 C.6∶3 D.3∶2答案:A2.(2018·浙江 11 月选考,T6)下列化学反应中溴元素仅被氧化的是( )A.2NaBr+Cl2===2NaCl+Br2B.Br2+2NaI===2NaBr+I2C.3Br2+6NaOH=====5NaBr+NaBrO3+3H2OD.HBr+NaOH===NaBr+H2O解析:选 A。A 项反应中溴元素化合价只升高,所以仅被氧化;B 项反应中溴元素化合价只降低,所以仅被还原;C 项反应中溴元素化合价既升高又降低,所以既被氧化又被还原;D 项反应中溴元素化合价没有变化,未发生氧化还原反应。3.(2018·浙江 4 月选考,T7)下列变化过程中,加入氧化剂才能实现的是( )A.Cl2→Cl- B.I-→I2C.SO2→SO D.C...