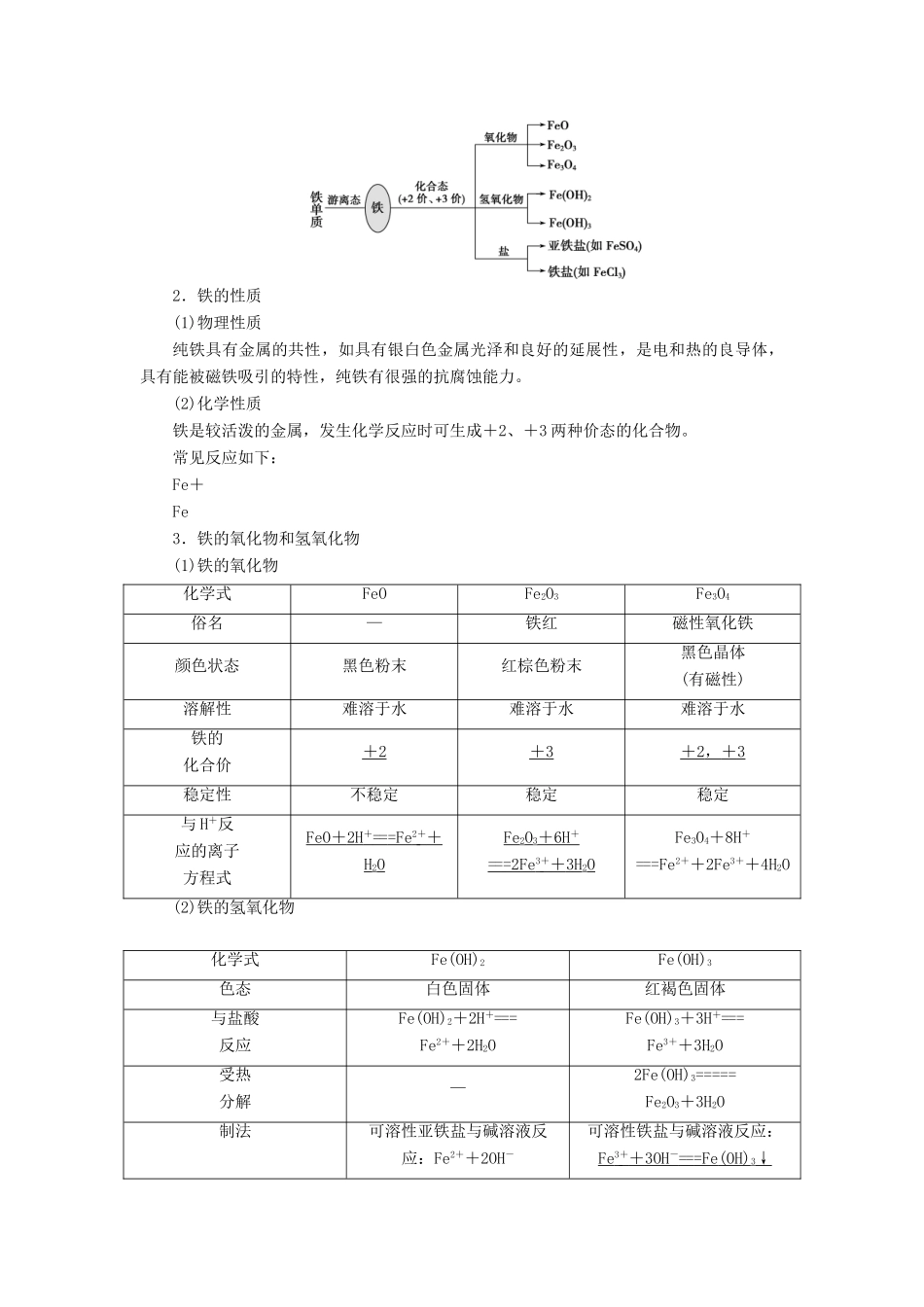
第三单元 铁、铜的获取及应用 金属矿物的开发和利用[考点分布]知识内容考试要求2016 年2017 年2018 年2019年2020年4月10 月4月11 月4 月11 月4 月1 月(1)自然界铁、铜的存在形式,铁、铜的物理性质a(2)工业炼铁的反应原理b(3)铁、铜的化学性质(跟某些非金属、酸、盐的反应)bT27T27、T31T6、T27T28T9、T10、T29T28T13、T25(4)Fe2+、Fe3+的性质及转化cT32(3)T6、T24T12T29T29T24T13、T27(5)检验 Fe2+、Fe3+的常用方法cT28(6)不锈钢的主要组成元素及其用途a(7)化学理论的建立和发展与人类认识世界的关系a(8)化学科学的研究内容和发展前景a(9)化学在合成新物质、提高人类生活质量方面的重要作用a(10)金属活动性与金属冶炼方法的关系aT8T9、T12 用物质分类思想认识铁及其重要化合物1.铁的存在2.铁的性质(1)物理性质纯铁具有金属的共性,如具有银白色金属光泽和良好的延展性,是电和热的良导体,具有能被磁铁吸引的特性,纯铁有很强的抗腐蚀能力。(2)化学性质铁是较活泼的金属,发生化学反应时可生成+2、+3 两种价态的化合物。常见反应如下:Fe+Fe3.铁的氧化物和氢氧化物(1)铁的氧化物化学式FeOFe2O3Fe3O4俗名—铁红磁性氧化铁颜色状态黑色粉末红棕色粉末黑色晶体(有磁性)溶解性难溶于水难溶于水难溶于水铁的化合价+ 2 + 3 + 2 , + 3 稳定性不稳定稳定稳定与 H+反应的离子方程式FeO + 2H + == =Fe 2 + + H2O Fe2O3+ 6H + == =2Fe 3 + + 3H 2O Fe3O4+8H+===Fe2++2Fe3++4H2O(2)铁的氢氧化物化学式Fe(OH)2Fe(OH)3色态白色固体红褐色固体与盐酸反应Fe(OH)2+2H+===Fe2++2H2OFe(OH)3+3H+===Fe3++3H2O受热分解—2Fe(OH)3=====Fe2O3+3H2O制法可溶性亚铁盐与碱溶液反应:Fe2++2OH-可溶性铁盐与碱溶液反应:Fe 3 + + 3OH - == =Fe (OH) 3↓===Fe(OH)2↓二者的关系在空气中,Fe(OH)2能够非常迅速地被氧气氧化成 Fe(OH)3,现象是白色絮状沉淀迅速变成灰绿色,最后变成红褐色,反应方程式为 4Fe (OH) 2+ O 2+ 2H 2O == =4Fe (OH) 34.亚铁盐和铁盐(1)亚铁盐含有 Fe2+的溶液呈浅绿色,Fe2+既有氧化性,又有还原性,Fe2+与 Zn、Cl2反应的离子方程式分别为 Zn + Fe 2 + == =Zn 2 + + Fe 、2Fe 2 + + Cl 2== =2Fe 3 + + 2Cl - 。(2)铁盐① 氧化性:含有 Fe3+的溶液呈棕黄色,Fe3+具有氧化性,Fe3+与 Fe、Cu...