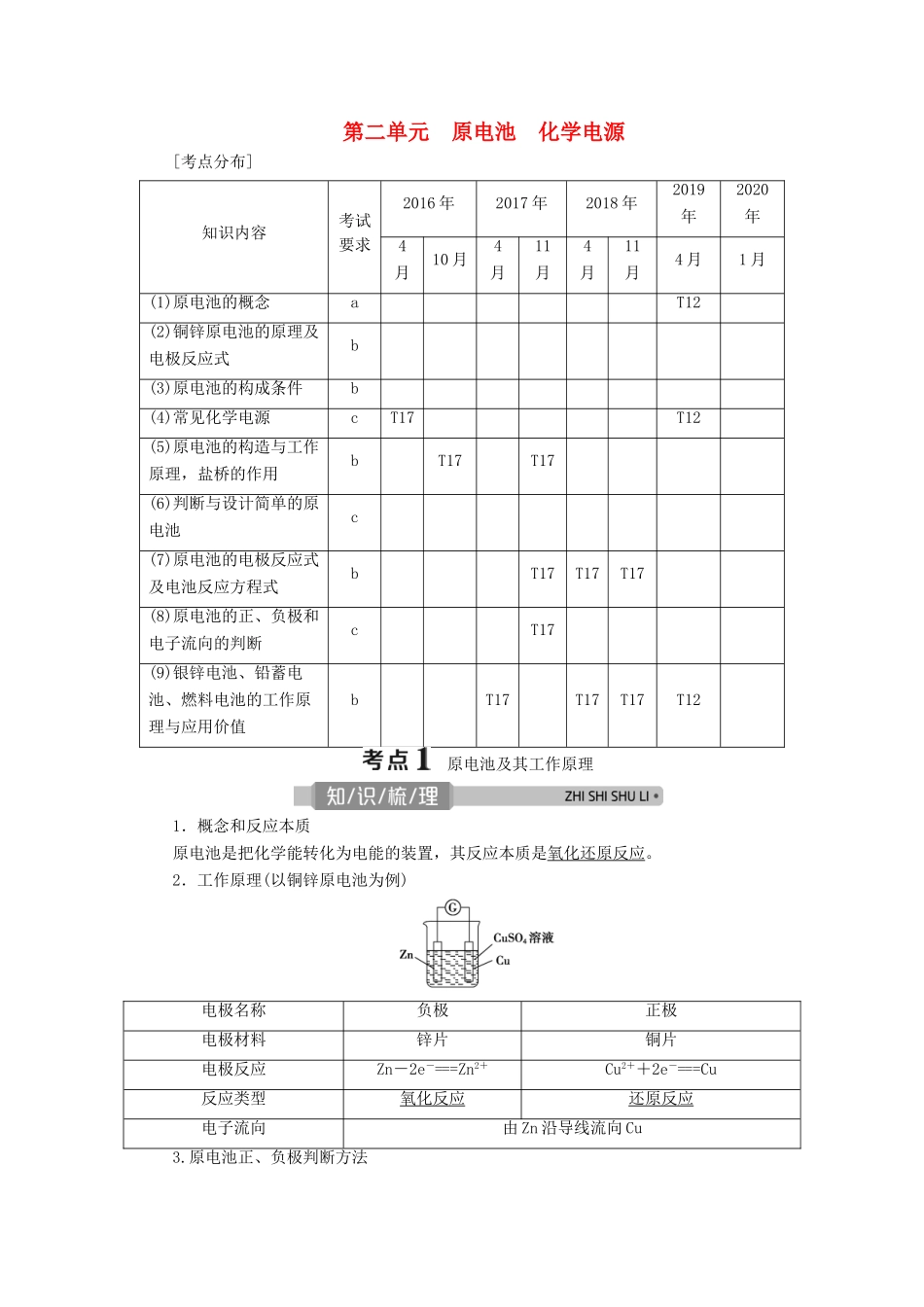
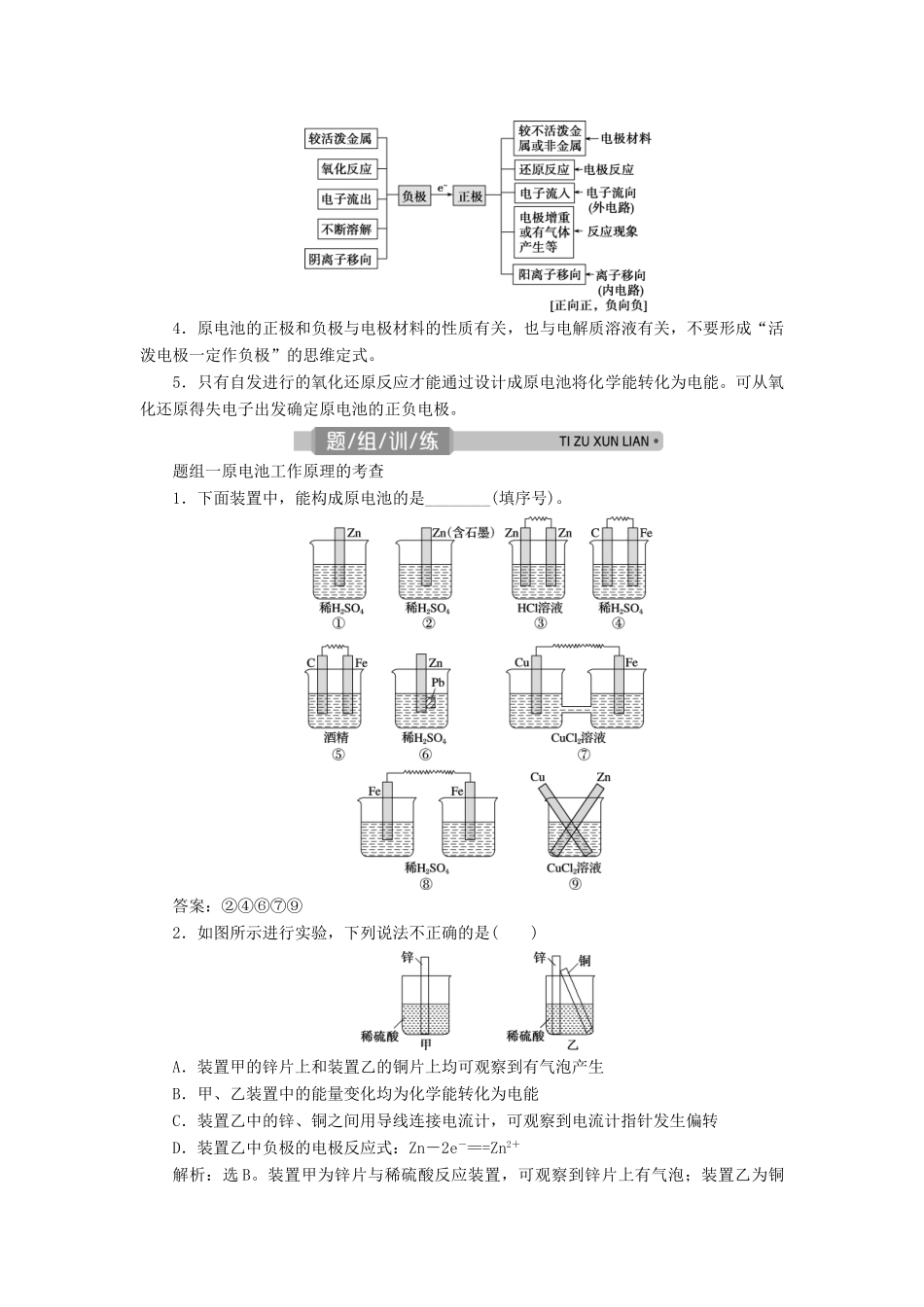
第二单元 原电池 化学电源[考点分布]知识内容考试要求2016 年2017 年2018 年2019年2020年4月10 月4月11月4月11月4 月1 月(1)原电池的概念aT12(2)铜锌原电池的原理及电极反应式b(3)原电池的构成条件b(4)常见化学电源cT17T12(5)原电池的构造与工作原理,盐桥的作用bT17T17(6)判断与设计简单的原电池c(7)原电池的电极反应式及电池反应方程式bT17T17T17(8)原电池的正、负极和电子流向的判断cT17(9)银锌电池、铅蓄电池、燃料电池的工作原理与应用价值bT17T17T17T12 原电池及其工作原理1.概念和反应本质原电池是把化学能转化为电能的装置,其反应本质是氧化还原反应。2.工作原理(以铜锌原电池为例)电极名称负极正极电极材料锌片铜片电极反应Zn-2e-===Zn2+Cu2++2e-===Cu反应类型氧化反应还原反应电子流向由 Zn 沿导线流向 Cu3.原电池正、负极判断方法4.原电池的正极和负极与电极材料的性质有关,也与电解质溶液有关,不要形成“活泼电极一定作负极”的思维定式。5.只有自发进行的氧化还原反应才能通过设计成原电池将化学能转化为电能。可从氧化还原得失电子出发确定原电池的正负电极。题组一原电池工作原理的考查1.下面装置中,能构成原电池的是________(填序号)。答案:②④⑥⑦⑨2.如图所示进行实验,下列说法不正确的是( )A.装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生B.甲、乙装置中的能量变化均为化学能转化为电能C.装置乙中的锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转D.装置乙中负极的电极反应式:Zn-2e-===Zn2+解析:选 B。装置甲为锌片与稀硫酸反应装置,可观察到锌片上有气泡;装置乙为铜锌原电池,锌片、铜片和硫酸形成的原电池中,铜片为原电池正极,该极上氢离子得电子生成氢气,电极反应为 2H++2e-===H2↑,故装置乙的铜片上也可观察到有气泡产生。锌片为原电池负极,锌失电子,负极上的电极反应式为 Zn-2e-===Zn2+,电子由负极经导线流向正极,整个电路形成回路,产生电流,化学能转变为电能,锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转。故 A、C、D 正确;甲装置不是原电池,能量变化不是化学能转化为电能,没有产生电流,而乙装置是原电池,原电池中的能量变化为化学能转化为电能,B 不正确。题组二原电池正、负极和电子流向的判断3.下列有关原电池的说法中正确的是( )A.在内电路中,电子由正极流向负极B.在原电池中,相对较活泼的金属一定作负极...