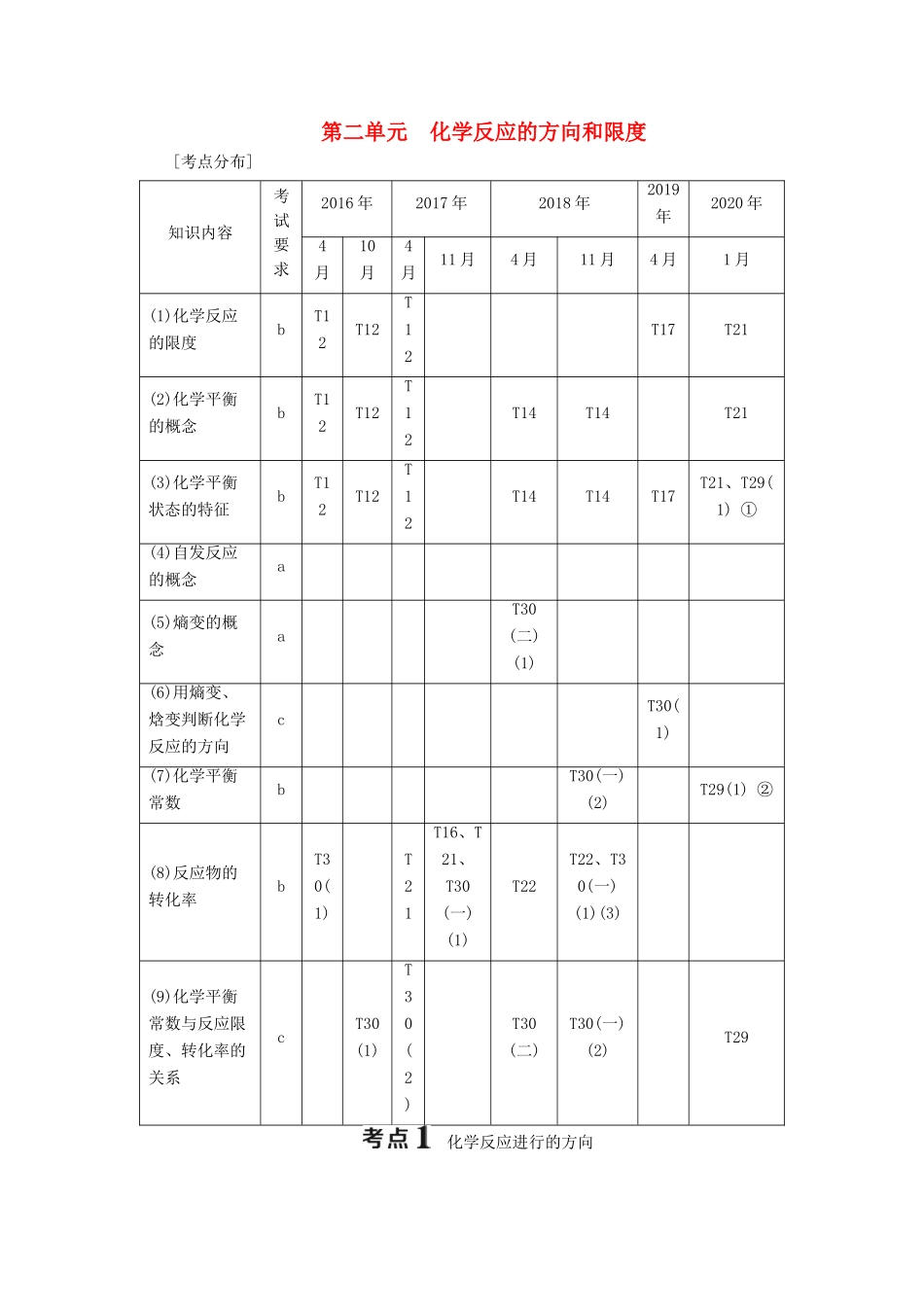
第二单元 化学反应的方向和限度[考点分布]知识内容考试要求2016 年2017 年2018 年2019年2020 年4月10月4月11 月4 月11 月4 月1 月(1)化学反应的限度bT12T12T12T17T21(2)化学平衡的概念bT12T12T12T14T14T21(3)化学平衡状态的特征bT12T12T12T14T14T17T21、T29(1) ①(4)自发反应的概念a(5)熵变的概念aT30(二)(1)(6)用熵变、焓变判断化学反应的方向cT30(1)(7)化学平衡常数bT30(一)(2)T29(1) ②(8)反应物的转化率bT30(1)T21T16、T21、T30(一)(1)T22T22、T30(一)(1)(3)(9)化学平衡常数与反应限度、转化率的关系cT30(1)T30(2)T30(二)T30(一)(2)T29 化学反应进行的方向一、自发反应1.自发过程(1)概念在一定条件下,不需要借助外力作用就能自动进行的过程。(2)特点① 体系趋向于从高能状态转变为低能状态(体系对外部做功或释放热量)。② 在密闭条件下,体系有从有序转变为无序的倾向性(无序体系更加稳定)。2.自发反应在一定条件下,无需外界帮助就能自发进行的反应称为自发反应。二、熵、熵变1.熵的概念熵是衡量一个体系混乱度的物理量。用符号 S 表示。同一条件下,不同物质有不同的熵值,同一物质在不同状态下熵值也不同,一般规律是 S(g)>S(l)>S(s)。2.熵变的概念熵变是反应前后体系熵的变化,用 Δ S 表示,化学反应的 ΔS 越大,越有利于反应自发进行。三、用熵变、焓变判断化学反应的方向1.熵变与反应方向研究表明,对于化学反应而言,决定化学反应能否自发进行的一个因素是体系的混乱度。大多数自发反应有趋向于体系混乱度增大的倾向。2.焓变与反应方向研究表明,对于化学反应而言,绝大多数放热反应都能自发进行,且反应放出的热量越多,体系能量降低得也越多,反应越完全。可见,反应的焓变是制约化学反应能否自发进行的另一个因素。3.综合判断反应方向的依据(1)ΔH-TΔS<0,反应能自发进行。(2)ΔH-TΔS=0,反应达到平衡状态。(3)ΔH-TΔS>0,反应不能自发进行。题组化学反应方向的判断1.实验证明,多数能自发进行的反应都是放热反应。对此说法的理解正确的是( )A.所有的放热反应都是自发进行的B.所有的自发反应都是放热的C.焓变是影响反应是否具有自发性的一种重要因素D.焓变是决定反应是否具有自发性的唯一判据答案:C2.(2020·金华高二质检)下列过程属于熵增加的是( )A.一定条件下,水由气态变成液态B.高温高压条件下使石墨转变成金刚石C.4NO2(g)+O2(g)===2N2O5 (g)D.固态碘升华答案:D3.(20...