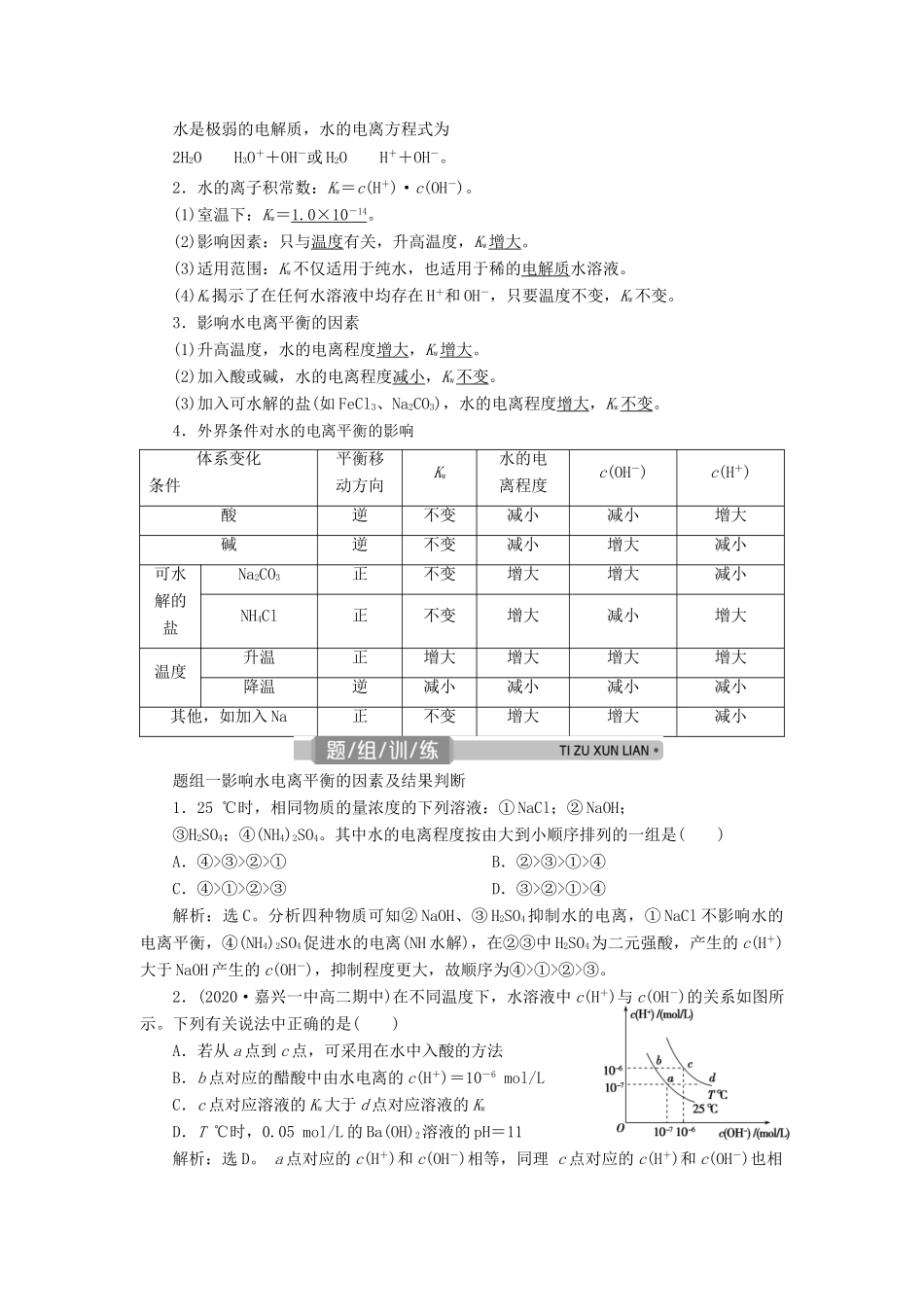
第二单元 溶液的酸碱性[考点分布]知识内容考试要求2016 年2017 年2018 年2019年2020 年4 月10 月4 月11 月4 月11 月4 月1 月(1)水的离子积常数bT30(3)①②(2)溶液的酸碱性与溶液中 c(H+)、c(OH-)的大小关系aT21T9T18T21T17(3)pH 的概念,pH 的大小与溶液酸碱性的关系aT18、T23T18T18T18T18T23(4)pH 的简单计算cT18T23(5)测定溶液酸碱性的方法,用 pH 试纸、pH 计测定溶液的 pHbT9(6)中和滴定原理及其操作方法bT31(5)T23T23(7)几种常见酸碱指示剂的变色范围aT26(3)T18T23 水的离子积常数1.水的电离水是极弱的电解质,水的电离方程式为2H2OH3O++OH-或 H2OH++OH-。2.水的离子积常数:Kw=c(H+)·c(OH-)。(1)室温下:Kw=1.0×10 - 14 。(2)影响因素:只与温度有关,升高温度,Kw增大。(3)适用范围:Kw不仅适用于纯水,也适用于稀的电解质水溶液。(4)Kw揭示了在任何水溶液中均存在 H+和 OH-,只要温度不变,Kw不变。3.影响水电离平衡的因素(1)升高温度,水的电离程度增大,Kw增大。(2)加入酸或碱,水的电离程度减小,Kw不变。(3)加入可水解的盐(如 FeCl3、Na2CO3),水的电离程度增大,Kw不变。4.外界条件对水的电离平衡的影响体系变化条件 平衡移动方向Kw水的电离程度c(OH-)c(H+)酸逆不变减小减小增大碱逆不变减小增大减小可水解的盐Na2CO3正不变增大增大减小NH4Cl正不变增大减小增大温度升温正增大增大增大增大降温逆减小减小减小减小其他,如加入 Na正不变增大增大减小题组一影响水电离平衡的因素及结果判断1.25 ℃时,相同物质的量浓度的下列溶液:① NaCl;② NaOH;③H2SO4;④(NH4)2SO4。其中水的电离程度按由大到小顺序排列的一组是( )A.④>③>②>① B.②>③>①>④C.④>①>②>③ D.③>②>①>④解析:选 C。分析四种物质可知② NaOH、③ H2SO4抑制水的电离,① NaCl 不影响水的电离平衡,④(NH4)2SO4促进水的电离(NH 水解),在②③中 H2SO4为二元强酸,产生的 c(H+)大于 NaOH 产生的 c(OH-),抑制程度更大,故顺序为④>①>②>③。2.(2020·嘉兴一中高二期中)在不同温度下,水溶液中 c(H+)与 c(OH-)的关系如图所示。下列有关说法中正确的是( )A.若从 a 点到 c 点,可采用在水中入酸的方法B.b 点对应的醋酸中由水电离的 c(H+)=10-6 mol/LC.c 点对应溶液的 Kw大于 d 点对应溶液的 KwD.T ℃时,0.05 mol/L 的 Ba(OH)2溶液的 pH=1...