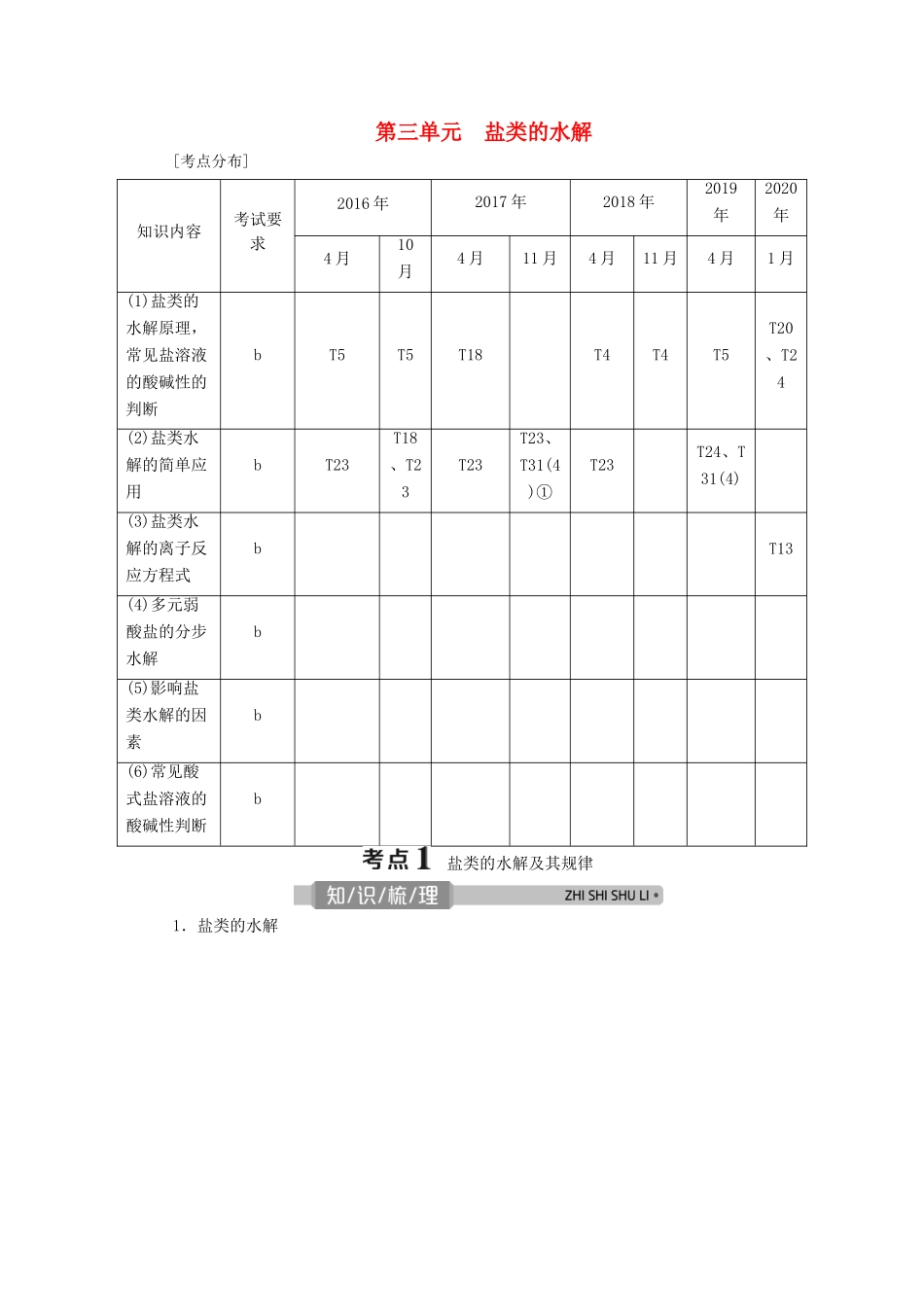
第三单元 盐类的水解[考点分布]知识内容考试要求2016 年2017 年2018 年2019年2020年4 月10月4 月11 月4 月11 月4 月1 月(1)盐类的水解原理,常见盐溶液的酸碱性的判断bT5T5T18T4T4T5T20、T24(2)盐类水解的简单应用bT23T18、T23T23T23、T31(4)①T23T24、T31(4)(3)盐类水解的离子反应方程式bT13(4)多元弱酸盐的分步水解b(5)影响盐类水解的因素b(6)常见酸式盐溶液的酸碱性判断b 盐类的水解及其规律1.盐类的水解2.盐类水解的规律有弱才水解,越弱越水解;谁强显谁性,同强显中性。盐的类型实例是否水解水解的离子溶液的酸碱性溶液的 pH强酸强碱盐NaCl、KNO3否—中性pH=7强酸弱碱盐NH4Cl、Cu(NO3)2是NH__、Cu 2 + 酸性pH<7弱酸强碱盐CH3COONa、Na2CO3是CH3COO - 、CO__碱性pH>73.表示方法——水解离子方程式(1)一般来说,盐类水解的程度不大,应该用可逆号“”表示。盐类水解一般不会产 生 沉 淀 和 气 体 , 所 以 不 用 符 号 “ ↓ ” 和 “ ↑ ” 表 示 水 解 产 物 。 例 如 : Cu2 + +2H2OCu(OH)2+2H+;NH+H2ONH3·H2O+H+。(2)多元弱酸盐的水解是分步进行的,水解离子方程式要分步表示。例如:Na2CO3水解反应的离子方程式为 CO+H2OHCO+OH-、HCO+H2OH2CO3+OH-。(3)多元弱碱阳离子的水解简化成一步完成,如 FeCl3溶液中:Fe3++3H2OFe(OH)3+3H+。(4)水解分别显酸性和碱性的离子组由于相互促进水解程度较大 ,书写时要用“===”“↑”“↓” 等 。 例 如 : NaHCO3 与 AlCl3 混 合 溶 液 反 应 的 离 子 方 程 式 : Al3 + +3HCO===Al(OH)3↓+3CO2↑。题组一规范书写盐类水解离子方程式1.下列各式表示水解反应的是( )A.HCO+H2OH3O++COB.HS-+H2OH2S+OH-C.H2PO+H2OHPO+H3O+D.HCO+OH-H2O+CO解析:选 B。A 项和 C 项是电离方程式,D 项是 HCO 与 OH-发生的离子反应。2.按要求书写离子方程式。(1)将 NaHCO3溶液与 AlCl3溶液混合:____________________________________________。(2)制备 Al(OH)3胶体:_________________________________________。(3)NaHS 溶液呈碱性,原因:____________________________________________。(4)对于易溶于水的正盐 MnRm溶液,若 pH>7,其原因是_________________________;若 pH<7,其原因是____________________________________...