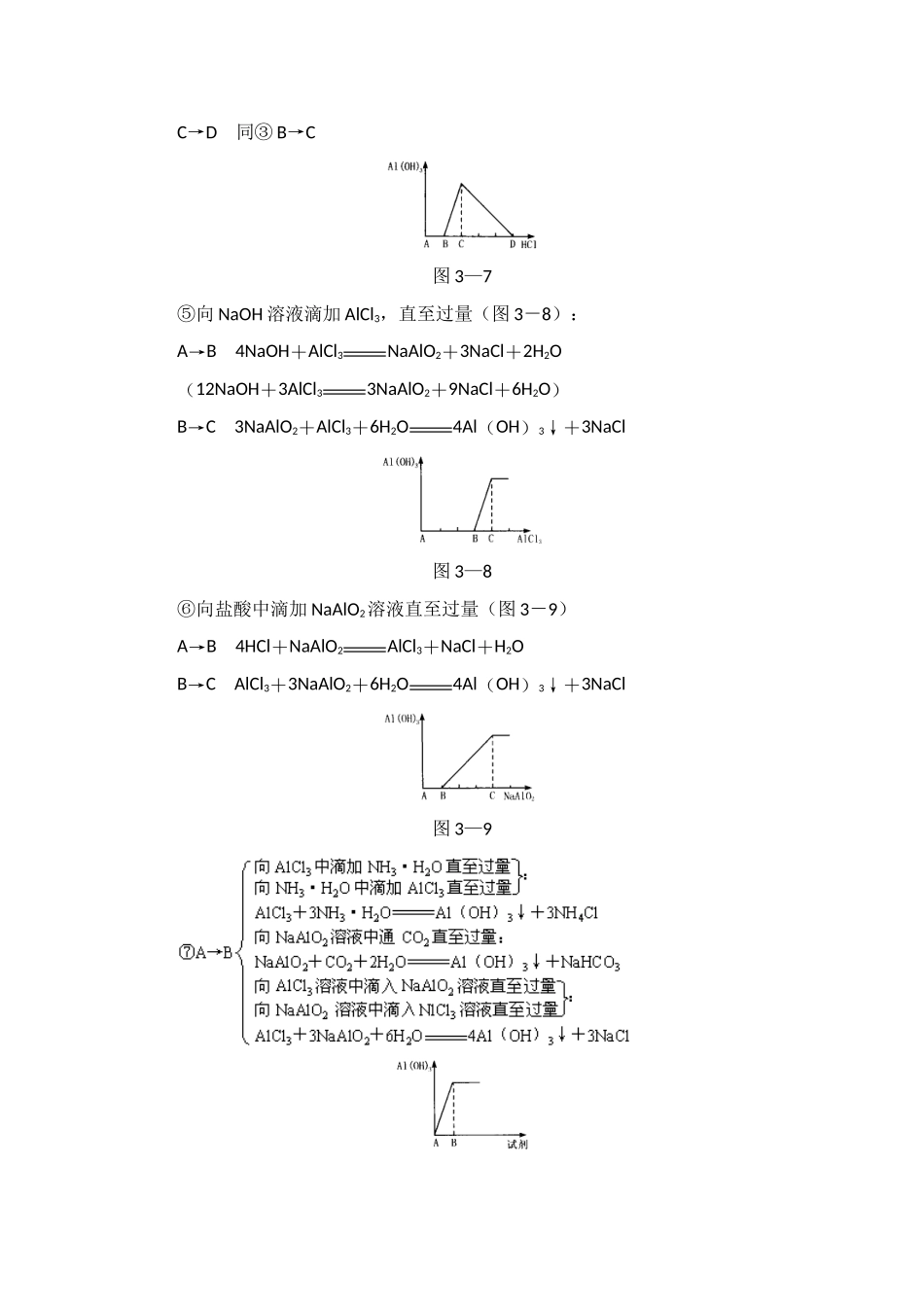
从铝土矿到铝合金素材规律总结 规律一:氢氧化铝的两性 氢氧化铝的两性一直是高考热点之一,其原因在于它的典型性,相关的反应可用下式表示: A1OAl(OH)3Al3+ 由于氢氧化铝既可溶于强碱又可溶于强酸,所以制备氢氧化铝宜采用以下途径: ①铝盐与氨水的反应:Al3++3NH3·H2OAl(OH)3↓+3NH ②偏铝酸盐与碳酸的反应:AlO+CO2+2H2OAl(OH)3↓+NaHCO3 ③ Al3 + 与 AlO在 溶 液 中 的 双 水 解 反 应 : Al3 + + 3AlO+ 6H2O4Al(OH)3↓ 规律二:Al 与 NaOH 溶液反应的电子转移表示方法 Al 与 NaOH 溶液反应,首先是 Al 与水电离出的 H+发生氧化还原反应: 生成的 Al(OH)3随即与 NaOH 发生复分解反应:Al(OH)3+NaOHNaAlO2+2H2O 以上反应综合起来可表示为 在反应中只有水电离出的 H+能接受 Al 给出的电子,NaOH 及水电离的 OH-本身带负电不能接受电子,若不需表示电子转移,则只需写成:2Al+2H2O+2NaOHNaAlO2+3H2↑ 规律三:氢氧化铝沉淀的图象分析 氢氧化铝沉淀图象大致可分为以下 8 类〔主要围绕 A1(OH)3沉淀的生成和溶解展开研究〕: ①向 AlCl3溶液中滴加 NaOH 溶液直至过量(图 3-4): A→B AlCl3+3NaOHAl(OH)3↓+3NaCl B→C NaOH+Al(OH)3NaAlO2+2H2O图 3—4 ②向盐酸酸化后的 AlCl3溶液滴加 NaOH 溶液直至过量(3-5): A→B HCl+NaOHNaCl+H2O B→C AlCl3+3NaOHAl(OH)3↓+3NaCl C→D NaOH+Al(OH)3NaAlO2+2H2O图 3—5 ③向 NaAlO2溶液滴加 HCl 至过量(图 3-6): A→B:NaA1O2+HCl+H2ONaCl+Al(OH)3↓ B→C:Al(OH)3+3HClAlCl3+3H2O图 3—6 ④向 NaOH 与 NaAlO2混合液中滴加 HCl 直至过量(图 3-7): A→B HCl+NaOHNaCl+H2O B→C 同③ A→B C→D 同③ B→C图 3—7 ⑤向 NaOH 溶液滴加 AlCl3,直至过量(图 3-8): A→B 4NaOH+AlCl3NaAlO2+3NaCl+2H2O (12NaOH+3AlCl33NaAlO2+9NaCl+6H2O) B→C 3NaAlO2+AlCl3+6H2O4Al(OH)3↓+3NaCl图 3—8 ⑥向盐酸中滴加 NaAlO2溶液直至过量(图 3-9) A→B 4HCl+NaAlO2AlCl3+NaCl+H2O B→C AlCl3+3NaAlO2+6H2O4Al(OH)3↓+3NaCl图 3—9 图 3—10 ⑧向等物质的量混合的 MgCl2、AlCl3 溶液中滴加 NaOH 直至过量(图 3-11): A→B MgCl2+2NaOHMg(OH)2↓+2NaCl AlCl3+3NaOHAl(OH)...