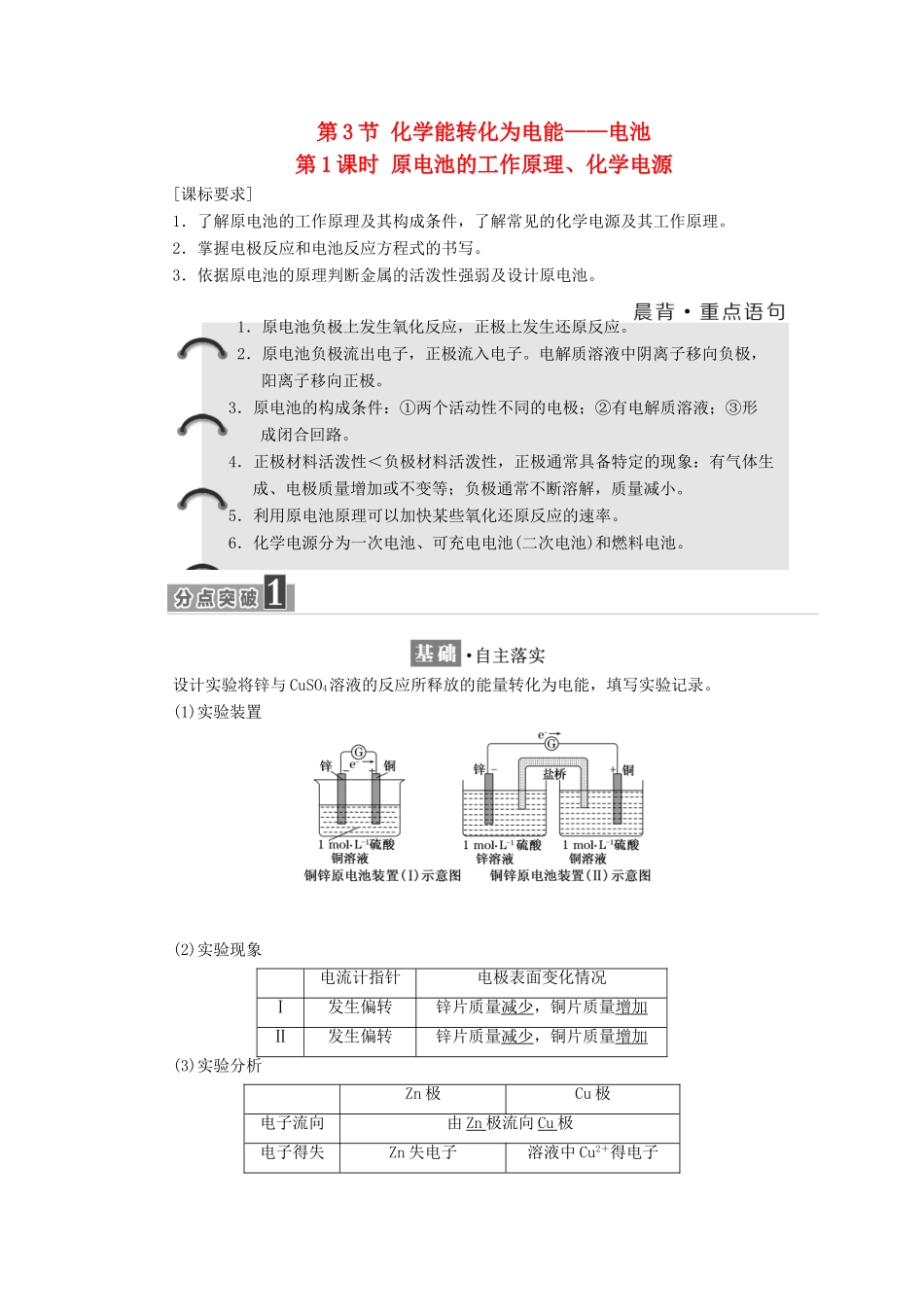
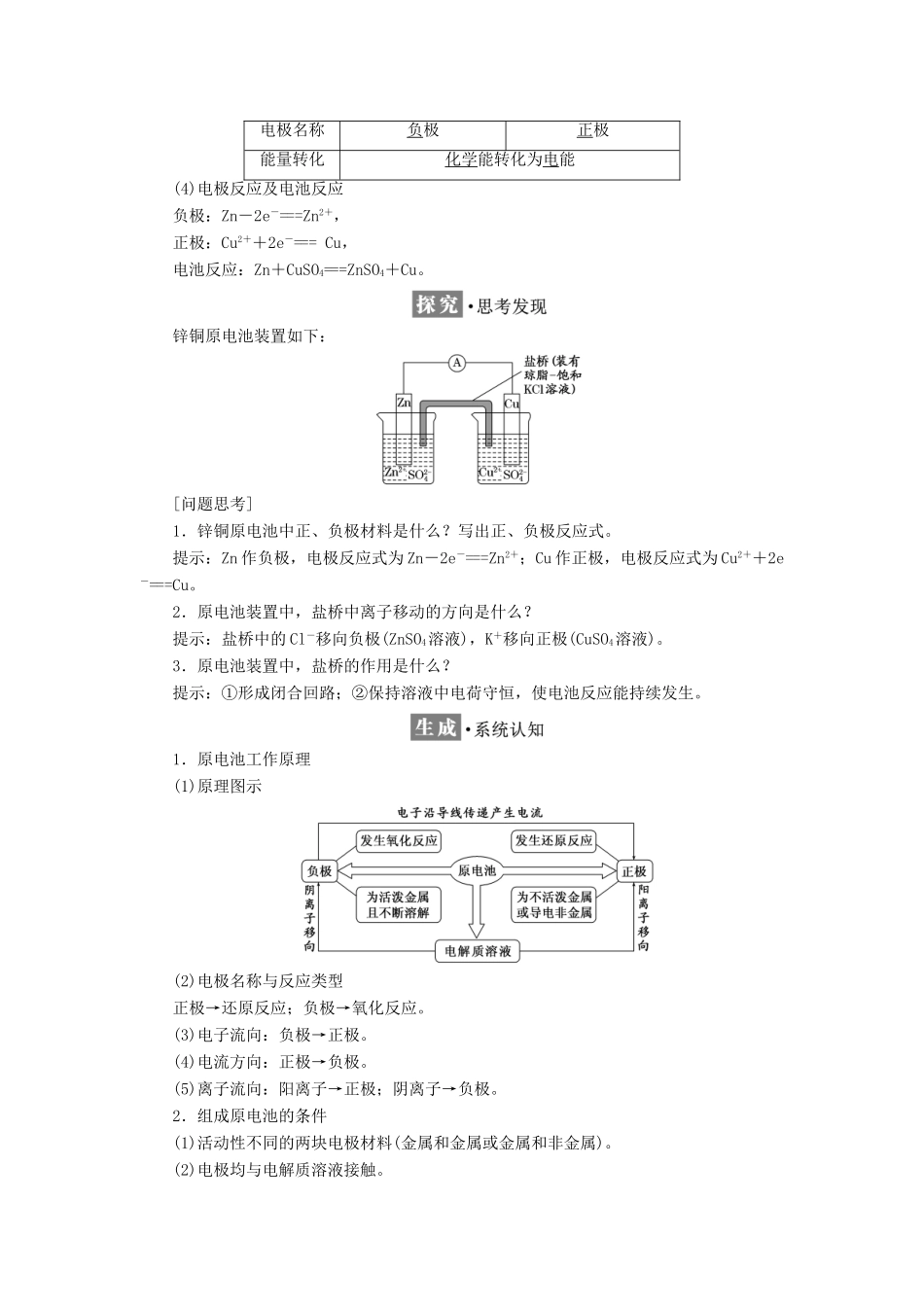
第 3 节 化学能转化为电能——电池第 1 课时 原电池的工作原理、化学电源[课标要求]1.了解原电池的工作原理及其构成条件,了解常见的化学电源及其工作原理。2.掌握电极反应和电池反应方程式的书写。3.依据原电池的原理判断金属的活泼性强弱及设计原电池。1.原电池负极上发生氧化反应,正极上发生还原反应。2.原电池负极流出电子,正极流入电子。电解质溶液中阴离子移向负极,阳离子移向正极。3.原电池的构成条件:①两个活动性不同的电极;②有电解质溶液;③形成闭合回路。4.正极材料活泼性<负极材料活泼性,正极通常具备特定的现象:有气体生成、电极质量增加或不变等;负极通常不断溶解,质量减小。5.利用原电池原理可以加快某些氧化还原反应的速率。6.化学电源分为一次电池、可充电电池(二次电池)和燃料电池。设计实验将锌与 CuSO4溶液的反应所释放的能量转化为电能,填写实验记录。(1)实验装置(2)实验现象电流计指针电极表面变化情况Ⅰ发生偏转锌片质量减少,铜片质量增加Ⅱ发生偏转锌片质量减少,铜片质量增加(3)实验分析Zn 极Cu 极电子流向由 Zn 极流向 Cu 极电子得失Zn 失电子溶液中 Cu2+得电子电极名称负极正极能量转化化学能转化为电能(4)电极反应及电池反应负极:Zn-2e-===Zn2+,正极:Cu2++2e-=== Cu,电池反应:Zn+CuSO4===ZnSO4+Cu。锌铜原电池装置如下:[问题思考]1.锌铜原电池中正、负极材料是什么?写出正、负极反应式。提示:Zn 作负极,电极反应式为 Zn-2e-===Zn2+;Cu 作正极,电极反应式为 Cu2++2e-===Cu。2.原电池装置中,盐桥中离子移动的方向是什么?提示:盐桥中的 Cl-移向负极(ZnSO4溶液),K+移向正极(CuSO4溶液)。3.原电池装置中,盐桥的作用是什么?提示:①形成闭合回路;②保持溶液中电荷守恒,使电池反应能持续发生。1.原电池工作原理(1)原理图示(2)电极名称与反应类型正极→还原反应;负极→氧化反应。(3)电子流向:负极→正极。(4)电流方向:正极→负极。(5)离子流向:阳离子→正极;阴离子→负极。2.组成原电池的条件(1)活动性不同的两块电极材料(金属和金属或金属和非金属)。(2)电极均与电解质溶液接触。(3)形成闭合电路。3.原电池正负极的判断方法(1)一般方法(2)特殊情况电极的正负除与金属的活动性有关外,还与电解质溶液有关。活泼金属一般作负极,但不是活泼金属一定作负极,如 Mg-Al-H2SO4溶液构成的原电池中,Mg 为负极,而在 Mg-Al-NaOH...