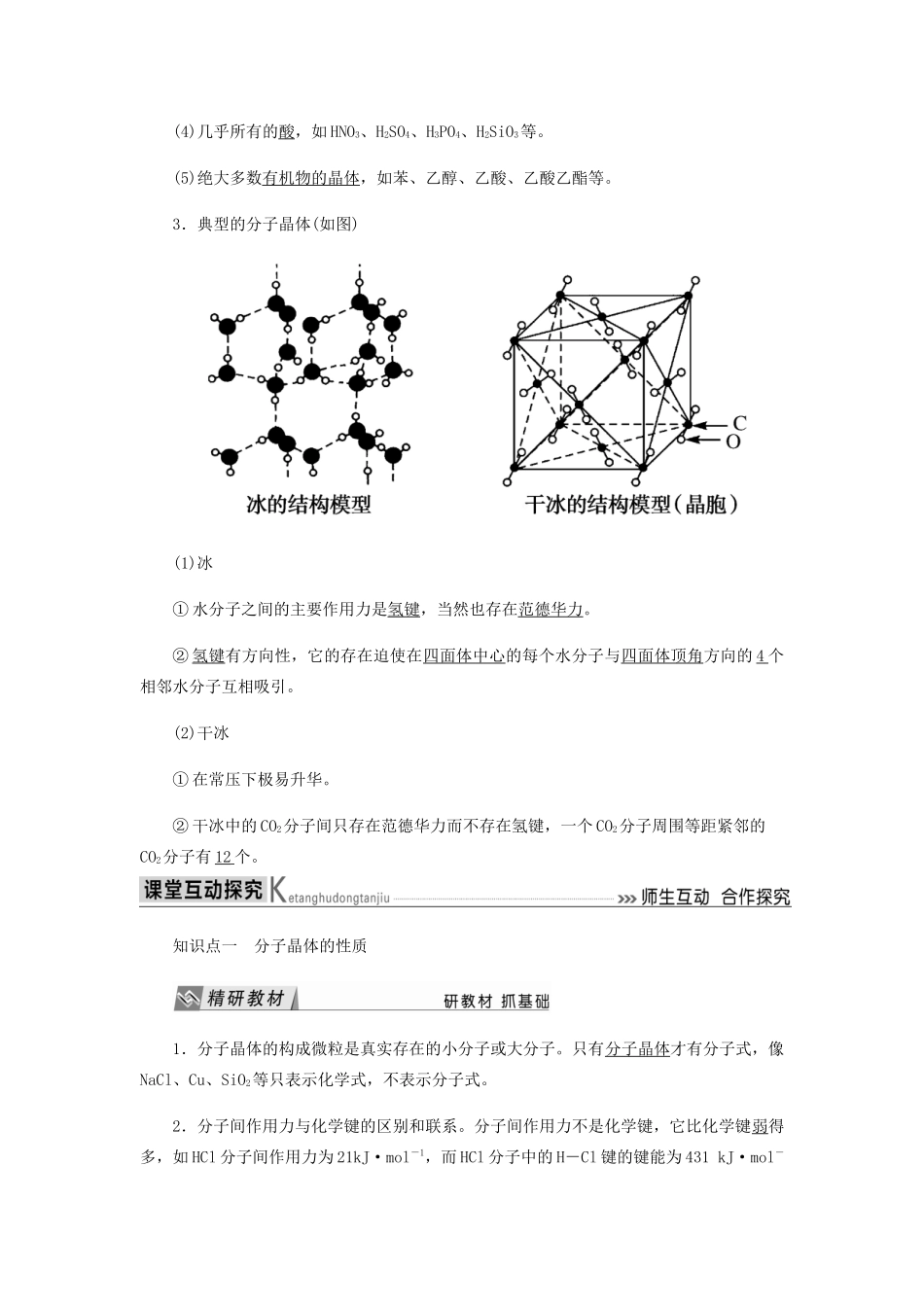
第一课时 分子晶体学习目标:1. 了解分子晶体的概念及结构特点。掌握分子晶体的性质。2. 能够通过分析分子晶体的组成微粒、结构模型及分子晶体中的作用力解释分子晶体的一些物理性质3.知道一些常见的属于分子晶体的物质类别。[知识回顾]什么是范德华力和氢键?存在于什么微粒间?主要影响物质的什么性质?答:范德华力是分子与分子之间存在的一种把分子聚集在一起的作用力。它是分子之间普遍存在的相互作用力,它使得许多物质能以一定的聚集态(固态和液态)存在。氢键:是由已经与电负性很强的原子(如 N、F、O)形成共价键的氢原子与另一个分子中或同一分子中电负性很强的原子之间的作用力。范德华力和氢键主要存在于分子之间,主要影响物质的物理性质。[要点梳理]1.分子晶体的概念及结构特点(1)分子晶体中存在的微粒:分子。(2)分子间以分子间作用力相结合形成的晶体叫分子晶体。(3)相邻分子间靠分子间作用力相互吸引。① 若分子间作用力只有范德华力,则分子晶体有分子密堆积特征,即每个分子周围有12 个紧邻的分子。② 分子间含有其他作用力,如氢键,则每个分子周围紧邻的分子要少于 12 个。如冰中每个水分子周围只有 4 个紧邻的水分子。2.常见的分子晶体(1)所有非金属氢化物,如 H2O、NH3、CH4等。(2)部分非金属单质,如卤素(X2)、氧气 O2、氮 N2、白磷(P4)、硫(S8)等。(3)部分非金属氧化物,如 CO2、P4O10、SO2、SO3等。(4)几乎所有的酸,如 HNO3、H2SO4、H3PO4、H2SiO3等。(5)绝大多数有机物的晶体,如苯、乙醇、乙酸、乙酸乙酯等。3.典型的分子晶体(如图)(1)冰① 水分子之间的主要作用力是氢键,当然也存在范德华力。② 氢键有方向性,它的存在迫使在四面体中心的每个水分子与四面体顶角方向的 4 个相邻水分子互相吸引。(2)干冰① 在常压下极易升华。② 干冰中的 CO2分子间只存在范德华力而不存在氢键,一个 CO2分子周围等距紧邻的CO2分子有 12 个。知识点一 分子晶体的性质1.分子晶体的构成微粒是真实存在的小分子或大分子。只有分子晶体才有分子式,像NaCl、Cu、SiO2等只表示化学式,不表示分子式。2.分子间作用力与化学键的区别和联系。分子间作用力不是化学键,它比化学键弱得多,如 HCl 分子间作用力为 21kJ·mol-1,而 HCl 分子中的 H-Cl 键的键能为 431 kJ·mol-1。通常化学键的键能为 120~800 kJ·mol-1,而分子间作用力通常每摩尔约为几十千焦。当破坏 HCl 分子间作用力时,只改...