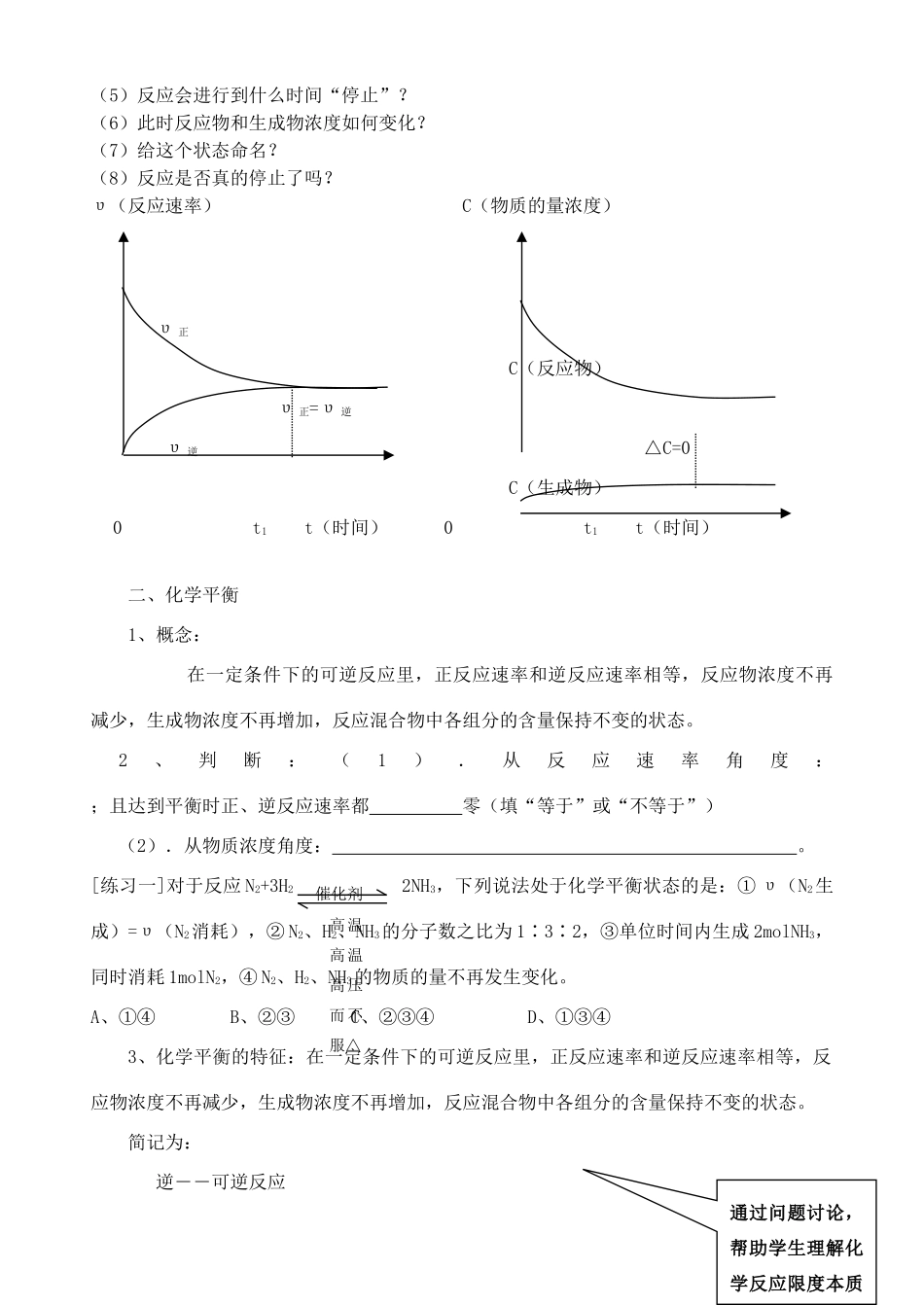
第三节 化学反应速率和限度(2 课时教学合案)学习目标:1.通过实验认识到任何化学反应的进程都有一定的限度,可以通过改变反应条件控制化学反应的限度。2.初步认识提高燃料燃烧效率的重要性和途径。3.认识可逆反应的涵义活动元一:实验探究,讨论分析建立反应限度的概念。[实验探究][分组实验]填表 1实验步骤在 一 支 试 管 中 加 入 3 ~ 4ml 1mol/L CaCl2 溶液,然后滴加1mol/L Na2SO4溶液 5~10ml静置,取上层清液少许,置于另一只试管中,向其中滴加适量 1mol/L Na2CO3溶液实验现象用离子方程式解释列出你对问题的 想法一、 可逆反应的限度1.可逆反应的概念: ;2.可逆反应在一定条件下,反应物 完全转化为生成物(填“能”或“不能”)3.可逆反应的特点:(1)、正反应和逆反应发生的条件相同,即同时存在,两者既对立又统一。(2)、反应物、生成物共同存在。活动元二:集体讨论,得出产生化学反应限度的原因、特征、判断依据。 [问题探究]在密闭容器中加入 1mol H2 和 1mol I2 发生反应:[投影] 正向 H2(g) + I2(g ) 2HI(g) 逆向 对以上反应,请分析:(1)当反应刚开始时,反应物和生成物的浓度哪个大?(2)当反应刚开始时,正反应和逆反应哪个反应速率大?(3)随着反应的进行,反应物和生成物浓度如何变化?(4)随着反应的进行,正反应速率和逆反应速率怎样变化?从 实 验 探 究 入手,让学生发现化学反应的可逆性通过问题讨论引导学生理解化学平衡状态如何建立。(5)反应会进行到什么时间“停止”?(6)此时反应物和生成物浓度如何变化?(7)给这个状态命名?(8)反应是否真的停止了吗?υ(反应速率) C(物质的量浓度) υ 正 C(反应物) υ 正=υ 逆 υ 逆 △C=0 C(生成物)0 t1 t(时间) 0 t1 t(时间)二、化学平衡1、概念: 在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应物浓度不再减少,生成物浓度不再增加,反应混合物中各组分的含量保持不变的状态。2、判断:(1).从反应速率角度: ;且达到平衡时正、逆反应速率都 零(填“等于”或“不等于”)(2).从物质浓度角度: 。[练习一]对于反应 N2+3H2 2NH3,下列说法处于化学平衡状态的是:① υ(N2生成)=υ(N2消耗),② N2、H2、NH3的分子数之比为 1∶3∶2,③单位时间内生成 2molNH3,同时消耗 1molN2,④ N2、H2、NH3的物质的量不再发生变化。A、①④ B、②③...