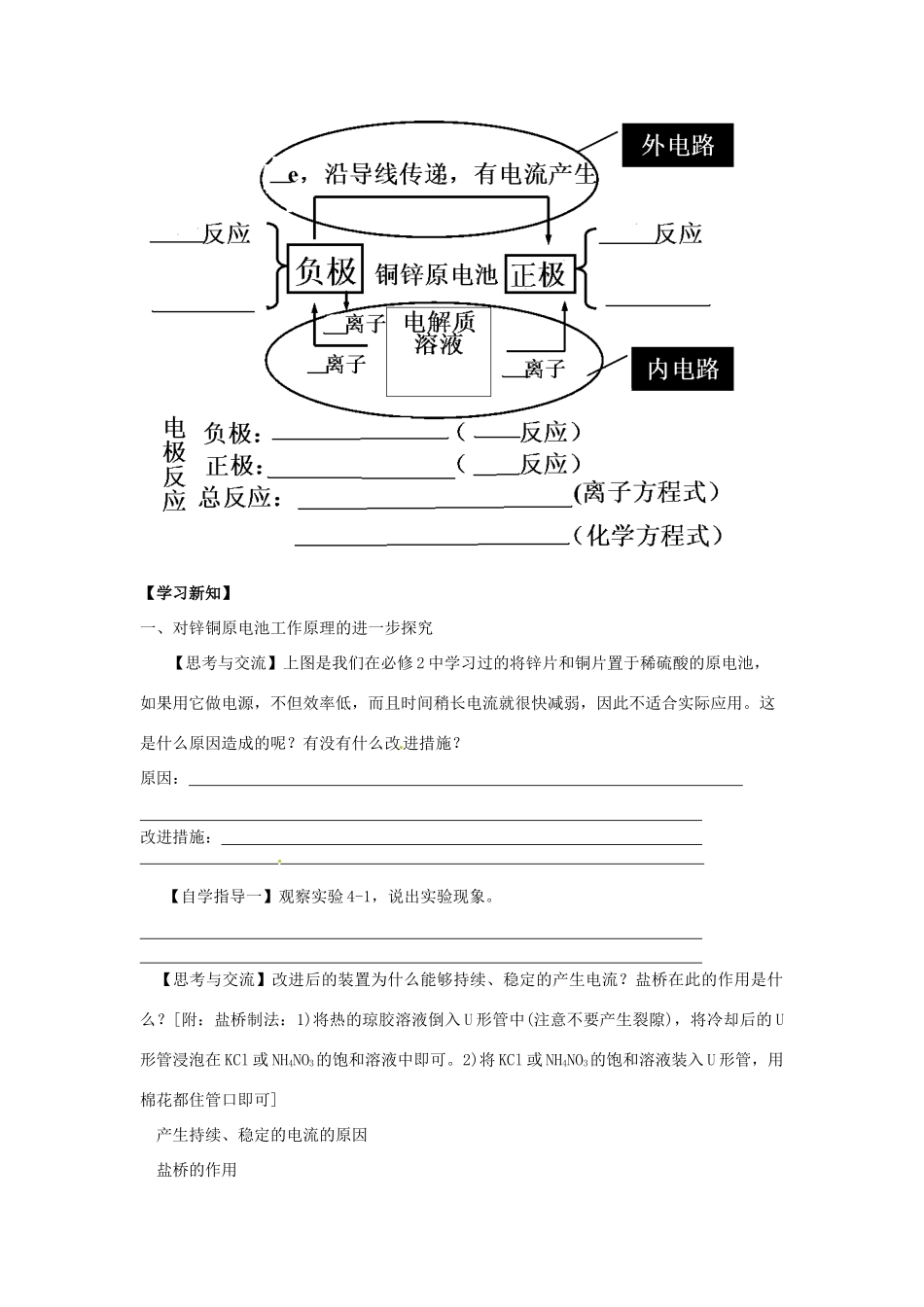
ZnZnCuCu××第一节原电池学案 班级 姓名 【学习目标】 体验化学能与电能相互转化的过程【学习重点】 初步认识原电池概念、原理、组成及应用。【学习难点】 通过对原电池实验的研究,从电子转移角度理解化学能向电能转化的本质 ,以及这种转化的综合利用价值。【温习旧知】1、原电池是______________________的装置。原电池反应的本质是_______________反应。2、如右图所示,组成的原电池:(1)当电解质溶液为稀 H2SO4 时: Zn 电极是____(填“正”或“负”)极,其电极反应为_______________,该反应是______(填“氧化”或“还原”,下同)反应; Cu 电极是______极,其电极反应为_______________,该反应是_________反应。(2)当电解质溶液为 CuSO4溶液时: Zn 电极是____极,其电极反应为_____________,该反应是________反应;Cu 电极是____极,其电极反应为_______________,该反应_________反应.3、原 电 池 原 理 : 填写页表中的空白【学习新知】一、对锌铜原电池工作原理的进一步探究【思考与交流】上图是我们在必修 2 中学习过的将锌片和铜片置于稀硫酸的原电池,如果用它做电源,不但效率低,而且时间稍长电流就很快减弱,因此不适合实际应用。这是什么原因造成的呢?有没有什么改进措施?原因: 改进措施: 【自学指导一】观察实验 4-1,说出实验现象。 【思考与交流】改进后的装置为什么能够持续、稳定的产生电流?盐桥在此的作用是什么?[附:盐桥制法:1)将热的琼胶溶液倒入 U 形管中(注意不要产生裂隙),将冷却后的 U形管浸泡在 KCl 或 NH4NO3的饱和溶液中即可。2)将 KCl 或 NH4NO3的饱和溶液装入 U 形管,用棉花都住管口即可]产生持续、稳定的电流的原因 盐桥的作用 二、由两个半电池组成原电池的工作原理(1)把氧化反应和还原反应分开在不同区域进行,再以适当方式连接,可以获得电流。① 在这类电池中,用 较强的物质作为负极,负极向外电路提供电子; 用 较弱的物质作为正极,正极从外电路得到电子。② 在原电池的内部,两极浸在电解质溶液中,并通过阴阳离子的定向运动而形成内电路。(2)组成原电池的条件a 。b 。c 。d 内部条件: 。(3)原电池的正负极的判断方法 微观判断(根据电子流动方向)宏观判断:① 根据电极材料② 根据原电池电极发生的反应③ 根据电极增重还是减重④ 根据电极有气泡冒出:(4)电解质溶液和电极材料的选择电解质溶液一般要能够与...