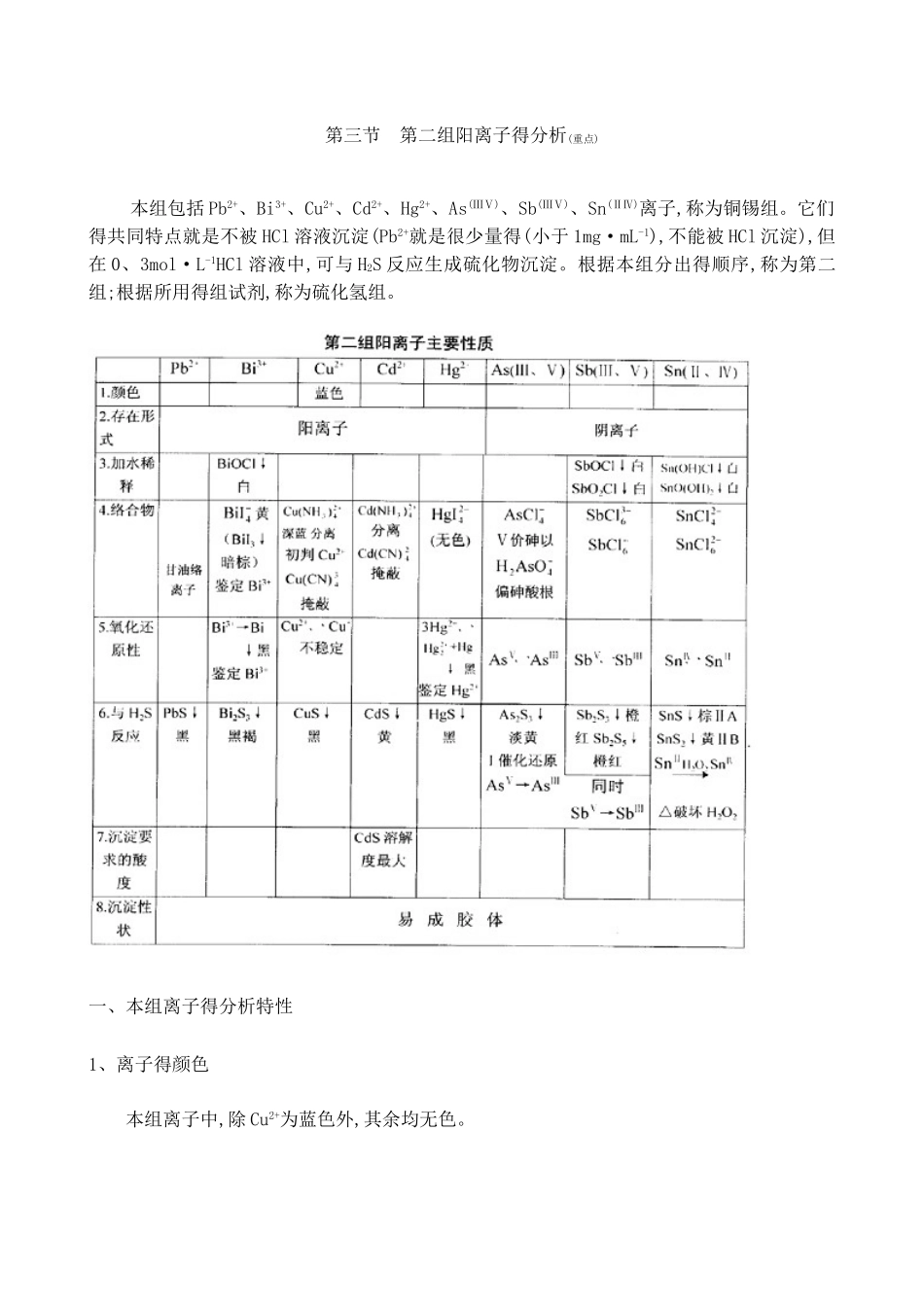
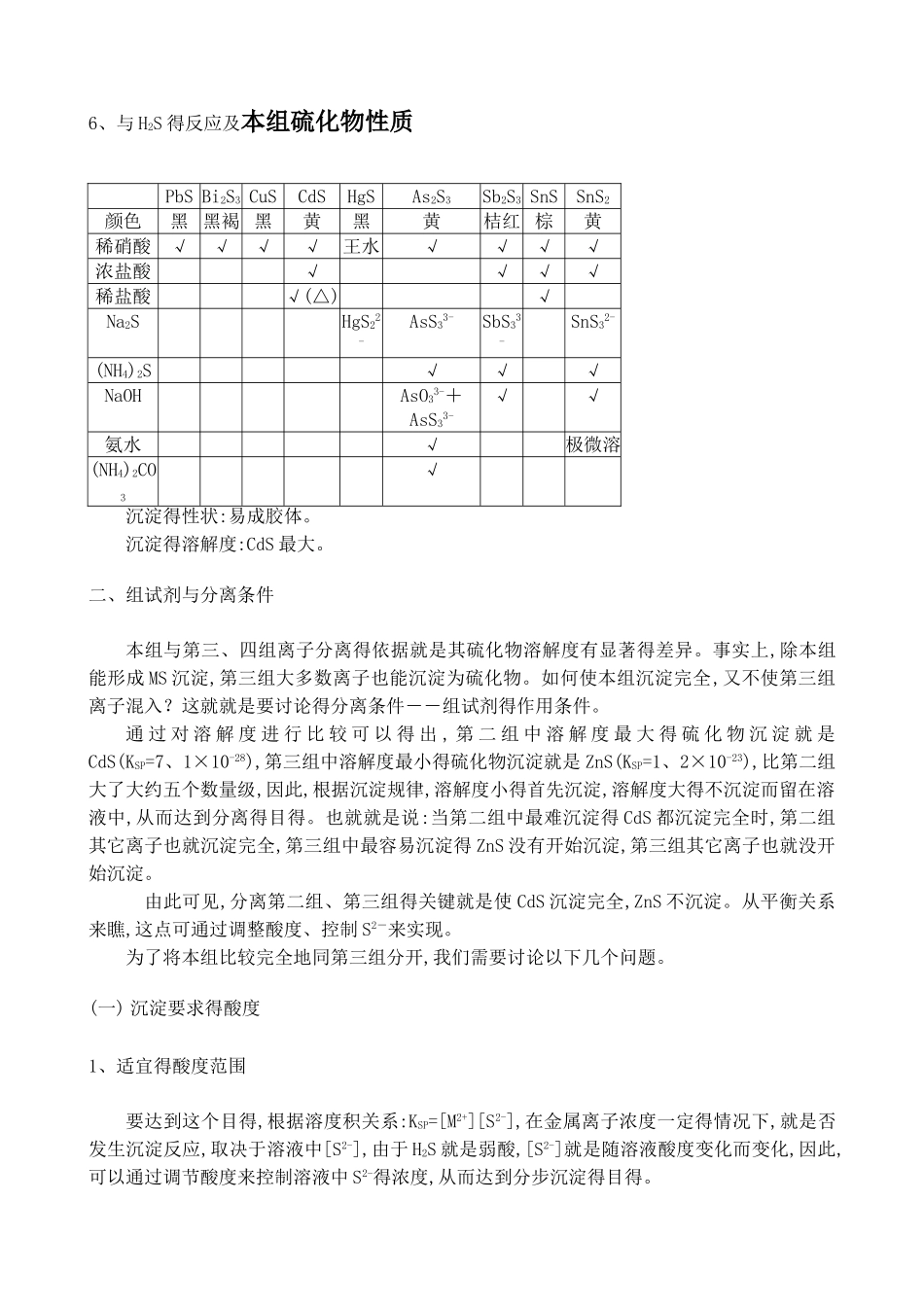
第三节 第二组阳离子得分析(重点)本组包括 Pb2+、Bi3+、Cu2+、Cd2+、Hg2+、As(ⅢⅤ)、Sb(ⅢⅤ)、Sn(ⅡⅣ)离子,称为铜锡组。它们得共同特点就是不被 HCl 溶液沉淀(Pb2+就是很少量得(小于 1mg·mL-1),不能被 HCl 沉淀),但在 0、3mol·L-1HCl 溶液中,可与 H2S 反应生成硫化物沉淀。根据本组分出得顺序,称为第二组;根据所用得组试剂,称为硫化氢组。一、本组离子得分析特性1、离子得颜色 本组离子中,除 Cu2+为蓝色外,其余均无色。2、离子得存在形式铅、铋、铜、镉、汞具有显著得金属性质,在水溶液中主要以金属阳离子得形式存在;而砷、锑、锡三种元素则表现出不同程度得非金属性质,它们在溶液中得主要存在形式随酸碱环境而不同,主要以阴离子形式存在于溶液中。但由于存在下述平衡 AsO33-+6H+=As3++3H2O SbCl63-= Sb3++ 6C1- SnCl42-=Sn2++4Cl-溶液中也或多或少地存在着简单阳离子,并能生成相应得硫化物(如 SnS2、As2S3等),所以这些元素还就是作为阳离子来讨论。鉴定时并不严格区分它们得存在形式,只就是泛指该元素,书写时只标出其氧化数,而不具体指明其存在形式。3、加水稀释Bi3+、Sb(ⅢⅤ)、Sn(ⅡⅣ)离子(见前表)4、络合物 本组离子一般都能生成多种络合物。其中最常见得就是氯络离子,因而大量 Cl-存在时可影 响 到 各 简 单 离 子 得 浓 度 。 另 外 ,Cu2+ 、 Cd2+ 等 能 生 成 氨 或 氰 络 离子:Cu(NH3)42+、Cd(NH3)42+、Cu(CN)42+、Cd(CN)42+ ,它们在 Cu2+、Cd2+得分离与鉴定上有很多应用。Bi3+与 I-生成黄色得 BiI4-;用于铋得鉴定。Cu2+、Pb2+与 Bi3+能与甘油生成络离子;Hg2+与I-生成无色得 HgI42-,它与 KOH 一起得溶液,可用于 NH4+得鉴定,称为奈氏试剂。这些都具有一定得分析应用价值。5、氧化还原性质 砷、锑、锡三元素得离子具有两种比较稳定得价态,它们在分析上都具有重要得意义。例如,As(V)在冷而稀得 HCl 溶液中,与 H2S 通过一系列得反应,最终得到得就是 As2S3↓,但这个过程速率较慢,为了加速反应,先将 As(V)还原为 As(Ⅲ)。通常使用 NH4I 来还原。另外,Sn(Ⅱ)还原性较强,很容易被氧化为 Sn(Ⅳ)。而且 SnS 不溶于 Na2S,而 SnS2 能溶于Na2S,这样在进一步分组时,把一种元素分在两个组中,将 Sn(Ⅱ)归于Ⅱ A 而 Sn(Ⅳ)归于Ⅱ B组,将使操作不便,故一般在进行沉淀之前加入 H2O2将 Sn(Ⅱ)全部氧化成 Sn(Ⅳ),并加热将剩余得H2O2除去。锑得罗丹明 B 试法只对 Sb(...