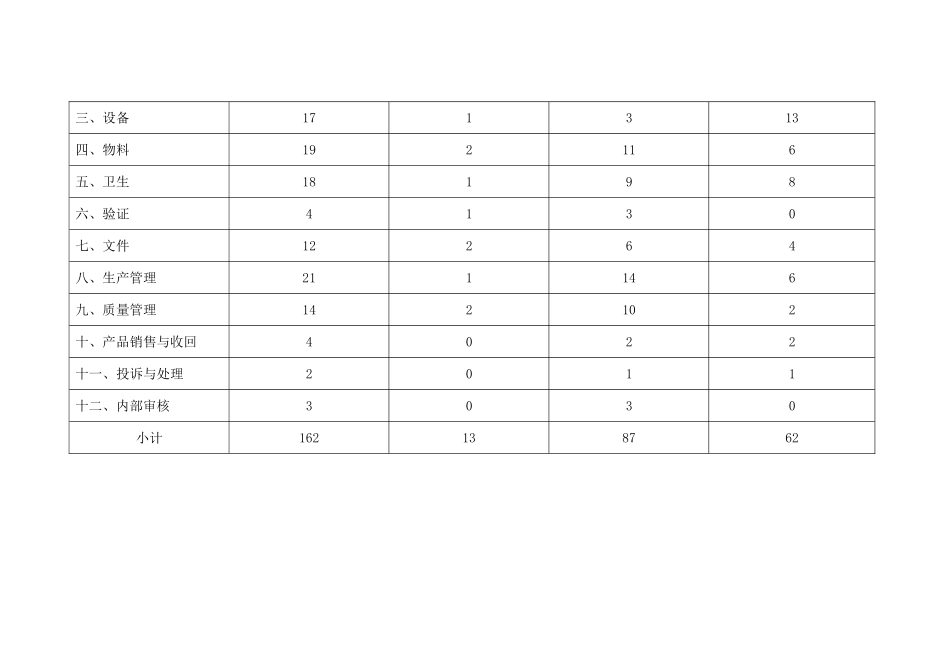
\全国牛血清生产企业达标检查手册中国医药生物技术协会医药生物技术产品质量控制专业委员会动物血清学组二○○九年十月二十四日 修订编辑说明一、根据 SFDA 药监注函【2001】129 号文“关于下发《全国牛血清质量管理研讨会纪要》的通知”精神和 2009 年 4 月 26 日 《全国新生牛血清质量管理座谈会纪要》,结合我国的实际情况制定本手册。二、本手册以 2025 年 SFDA《药品 GMP 认证检查评定标准》为依据,把检查的重点落在:溯源;强调牛血清供血点的管理;干净室(区)布局合理,完善干净室(区)空气净化系统,完善工艺用水系统;以批号为主线,全面法律规范相关的文件、记录;强化质量监管,做好初制品和成品质量检测工作和现场管理,以及开展关键工艺、设备、有关清洁消毒等方面的验证和内部审计等工作内容上。三、本手册共分机构与人员、厂房与设施、设备、物料、卫生、验证、文件、生产管理、质量管理、产品销售与收回、投诉与处理 、内部审核等十二个部分,共 162 项,其中一般项目 62 项,重要项目(*)87 项,否决项目(△)13 项。四、检查中发现不符合要求的项目统称为“缺陷项目”。其中,重要项目不符合要求者称为“严重缺陷”,一般项目不符合要求者称为“一般缺陷”,否决项目不符合要求者称为“否决”。五、在检查过程中,企业隐瞒有关情况或提供虚假材料的,按否决项目处理。检查组应调查取证并详细记录。六、结果评定(一) 未发现“否决”,且“严重缺陷”≤10%,且“一般缺陷” ≤20%,各类缺陷项目能够立即改正的,企业必须立即改正;不能立即改正的,企业必须提供缺陷整改报告及整改计划,方可通过达标认证。(二)发现“否决”或“严重缺陷”>10%或“一般缺陷” >20%的,不予通过达标认证。总条款△*一般条款一、机构与人员13175二、厂房与设施3521815三、设备171313四、物料192116五、卫生18198六、验证4130七、文件12264八、生产管理211146九、质量管理142102十、产品销售与收回4022十一、投诉与处理2011十二、内部审核3030小计162138762一 .机 构 与 人 员 ( 13 项 , 其 中 △ 1 项 , * 7 项 )条 款检 查 内 容通过否决检 查 情 况 1.1企 业 必 须 经 工 商 登 记 注 册 , 具 有 独 立 法 人 资 格 。* 1.2企 业 应 建 立 生 产 和 质 量 管 理 机 构 , 明 确 各 级 机 构和 人 员 的 职 责 。* 1.3...