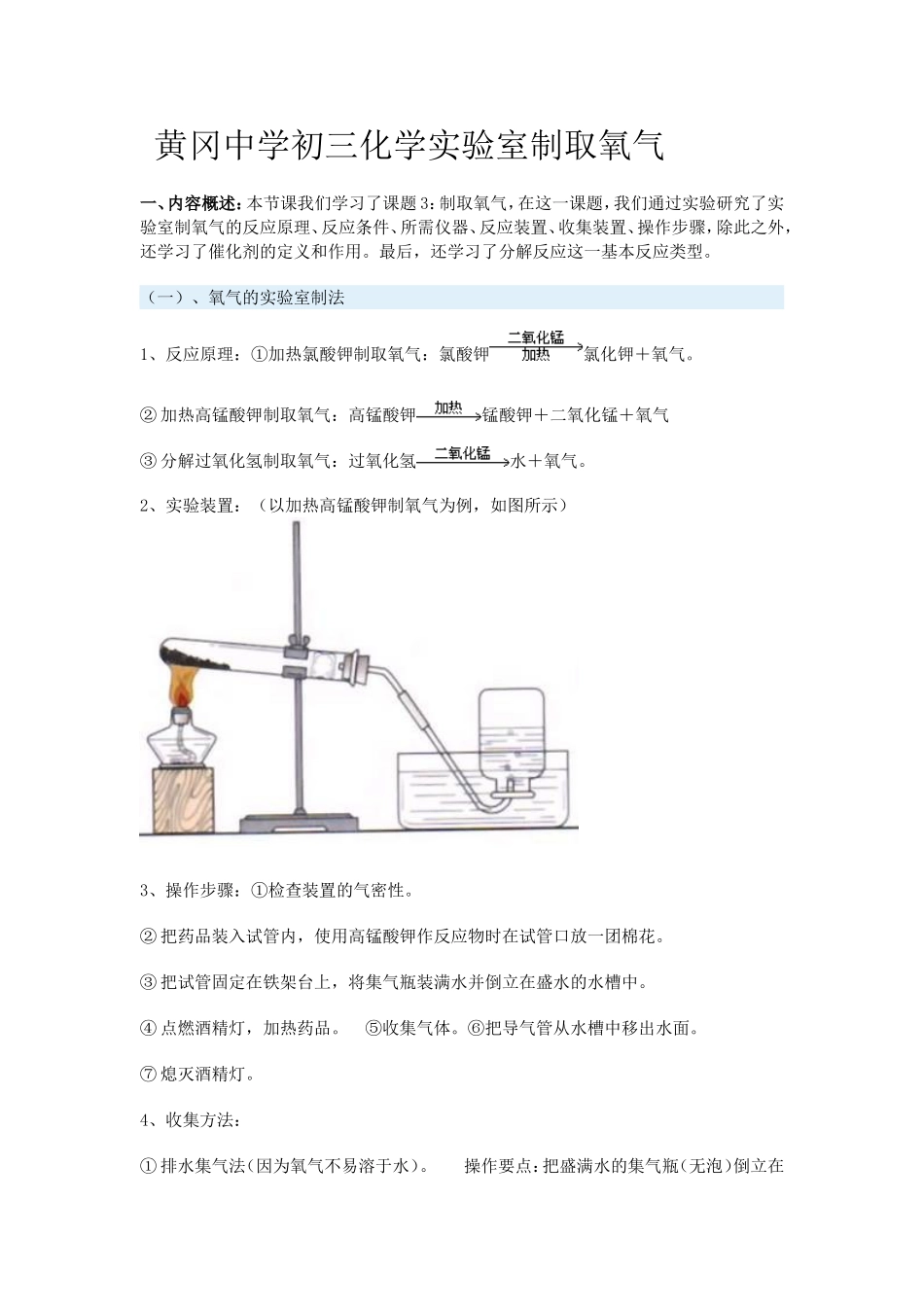
黄冈中学初三化学实验室制取氧气一、内容概述:本节课我们学习了课题 3:制取氧气,在这一课题,我们通过实验研究了实验室制氧气的反应原理、反应条件、所需仪器、反应装置、收集装置、操作步骤,除此之外,还学习了催化剂的定义和作用。最后,还学习了分解反应这一基本反应类型。(一)、氧气的实验室制法1、反应原理:①加热氯酸钾制取氧气:氯酸钾氯化钾+氧气。② 加热高锰酸钾制取氧气:高锰酸钾锰酸钾+二氧化锰+氧气③ 分解过氧化氢制取氧气:过氧化氢水+氧气。2、实验装置:(以加热高锰酸钾制氧气为例,如图所示)3、操作步骤:①检查装置的气密性。② 把药品装入试管内,使用高锰酸钾作反应物时在试管口放一团棉花。③ 把试管固定在铁架台上,将集气瓶装满水并倒立在盛水的水槽中。④ 点燃酒精灯,加热药品。 ⑤收集气体。⑥把导气管从水槽中移出水面。⑦ 熄灭酒精灯。4、收集方法:① 排水集气法(因为氧气不易溶于水)。 操作要点:把盛满水的集气瓶(无泡)倒立在水中,排水充气,取出放置。② 向上排空气法(因为氧气的密度略大于空气)。 操作要点:使导气管尽量伸入集气瓶底便于排尽空气。5、检验:将带火星的木条伸入集气瓶内,若木条复燃,证明瓶内气体是氧气。氧气可以使带火星的木条复燃6、验满:若用向上排空气法收集氧气,验满时,取一根带火星的木条,放在集气瓶口,若木条复燃,则证明氧气已集满。7、放置:因为氧气的密度大于空气的密度,故应正放在桌面上。8、注意事项:① 在用氯酸钾或高锰酸钾制取氧气时,试管口应略向下倾斜,原因是防止加热时药品中的湿存水倒流炸裂试管。② 铁夹应夹在距试管口 1/3 处,原因是利于加热。③ 导管伸入试管内要刚露出橡皮塞,原因是利于排出产生的气体。④ 用排水法收集氧气时,不宜立即收集,待有连续均匀的气泡产生时再收集,原因是开始的气泡是试管内的空气,若立即收集则氧气不纯。⑤ 排气法收集气体时,导管要伸入接近集气瓶底部,原因是利于充分排出瓶内空气。⑥ 实验结束时,先将导管移出水面,再熄灭酒精灯,原因是防止水槽中的水倒吸炸裂试管。⑦ 如果用高锰酸钾制氧气时,试管口应塞一小团棉花,原因是防止高锰酸钾粉末进入导管。(二)、正确选用气体的收集方法 原则:易溶于水的气体选排空气法收集,根据气体的密度定“向上”或“向下”排气,若气体的密度大于空气的密度,采用向上排空气集气法;若气体的密度小于空气的密度,采用向下排空气集...