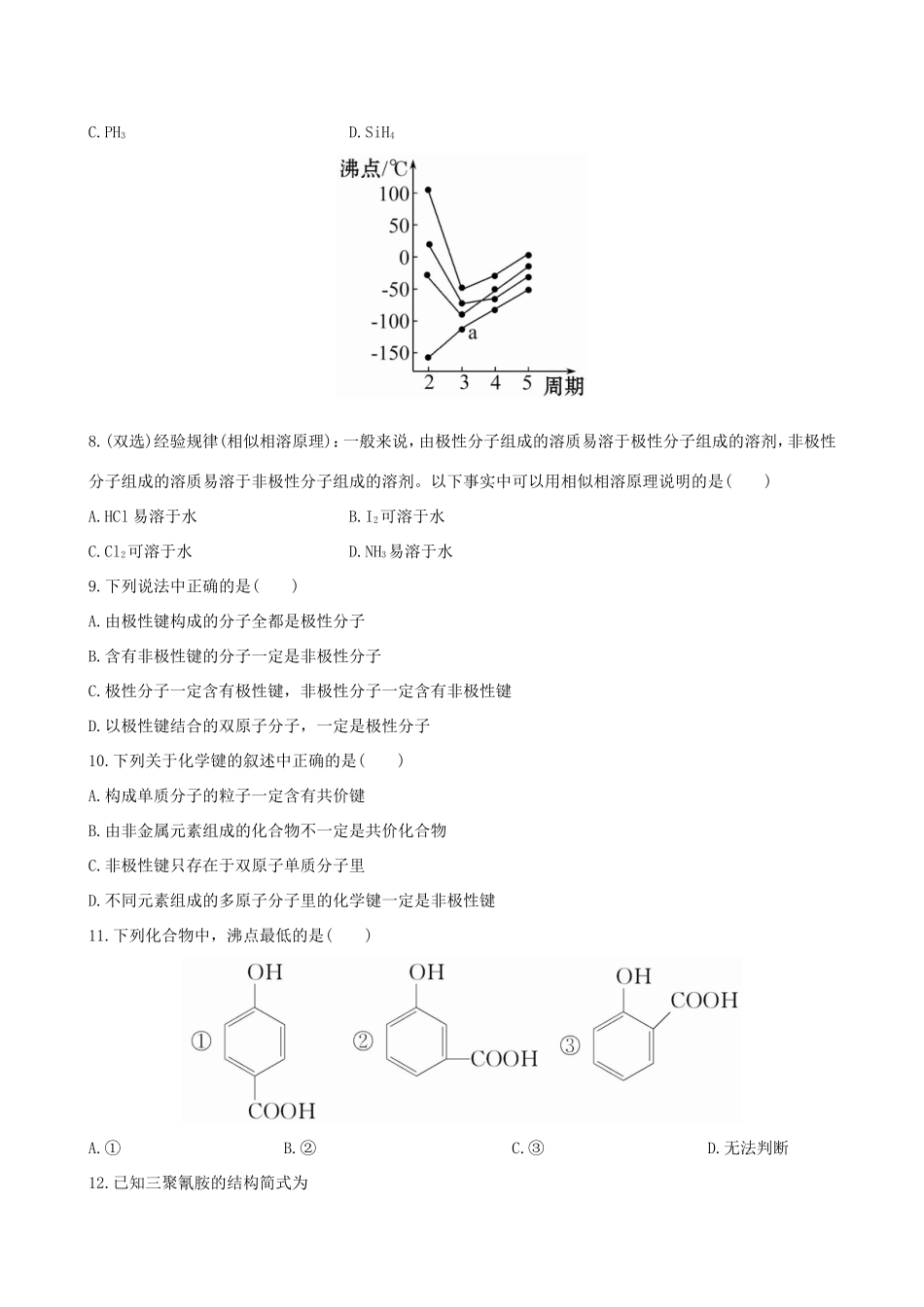
(45分钟100分)一、选择题(本题包括15小题,每小题4分,共60分)1.在以下的分子或离子中,空间结构的几何形状不是三角锥形的是()A.NF3B.CH3-C.BF3D.H3O+2.下列有关金属键的叙述中错误的是()A.金属键没有饱和性和方向性B.金属键是指金属阳离子和自由电子之间强烈的静电吸引作用C.金属键中的电子属于整块金属D.金属的性质和金属固体的形成都与金属键有关3.(2012·日照高二检测)下列元素的原子在形成不同物质时,既可形成离子键,又可形成极性键和非极性键的是()A.NaB.MgC.BrD.Ne4.(双选)下列描述中正确的是()A.CS2为V形的极性分子B.ClO3-的空间构型为平面三角形C.SF6中有6对完全相同的成键电子对D.SiF4和SO32-的中心原子均为sp3杂化5.下列关于氢键的说法中不正确的是()A.HF的沸点比HCl的沸点高是由于HF分子间存在氢键B.水在结冰时体积膨胀,是由于水分子之间存在氢键C.NH3的稳定性很强,是因为其分子间能形成氢键D.在氨水中水分子和氨分子之间也存在着氢键6.(2012·宿州高二检测)下列关于离子键和离子化合物的说法中正确的是()A.阴、阳离子通过静电引力形成离子键B.阴、阳离子间通过离子键一定能形成离子化合物C.离子化合物一定能导电D.只有在活泼金属元素和活泼非金属元素化合时,才能形成离子键7.如图所示每条折线表示周期表ⅣA族~ⅦA族中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是()A.H2SB.HClC.PH3D.SiH48.(双选)经验规律(相似相溶原理):一般来说,由极性分子组成的溶质易溶于极性分子组成的溶剂,非极性分子组成的溶质易溶于非极性分子组成的溶剂。以下事实中可以用相似相溶原理说明的是()A.HCl易溶于水B.I2可溶于水C.Cl2可溶于水D.NH3易溶于水9.下列说法中正确的是()A.由极性键构成的分子全都是极性分子B.含有非极性键的分子一定是非极性分子C.极性分子一定含有极性键,非极性分子一定含有非极性键D.以极性键结合的双原子分子,一定是极性分子10.下列关于化学键的叙述中正确的是()A.构成单质分子的粒子一定含有共价键B.由非金属元素组成的化合物不一定是共价化合物C.非极性键只存在于双原子单质分子里D.不同元素组成的多原子分子里的化学键一定是非极性键11.下列化合物中,沸点最低的是()A.①B.②C.③D.无法判断12.已知三聚氰胺的结构简式为,下列关于三聚氰胺的说法中正确的是()A.所有碳原子采用sp2杂化,所有氮原子采用sp3杂化B.一个分子中共含有15个σ键C.它属于极性分子,故极易溶于水D.它的微粒之间以金属键结合13.有五个系列同族元素的物质,101.3kPa时测定它们的沸点(℃)如下表所示:对应表中内容,下列叙述中正确的是()A.a、b、c代表的化学物质中均含化学键B.系列②物质均有氧化性;系列③物质对应水溶液均是强酸C.系列④中各化合物的稳定性顺序为H2O>H2S>H2Se>H2TeD.上表内物质HF和H2O,由于氢键的影响,其分子特别稳定14.(2012·漳州高二检测)下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是()A.B.C.D.15.现有如下各说法①在水中氢、氧原子间均以化学键相结合;②金属和非金属化合形成离子键;③离子键是阳离子与阴离子的相互吸引;④根据电离方程式:判断HCl分子里存在离子键;⑤H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成氢、氯原子,而后氢、氯原子形成离子键的过程。上述各种说法中正确的是()A.①②⑤正确B.都不正确C.④正确,其他不正确D.仅①不正确二、非选择题(本题包括3小题,共40分)16.(12分)过氧化氢(H2O2)又叫双氧水,其水溶液可用于制备工业上的漂白剂、特殊环境里燃料燃烧的助燃剂、医疗上的消毒剂、实验室里的制氧剂等。过氧化钠(Na2O2)可用于制备工业上的漂白剂、实验室里的制氧剂、呼吸面具或潜水艇中的制氧剂等。过氧原子团“O2”由2个氧原子共用1对电子形成。(1)分别写出H2O2、Na2O2的电子式:_________________________________、__________________________________________________________________。(2)①H2O、H2O2中化学键的不同点是_______________________________。②Na2O、Na2O2中化学键的不同点是___________________________________。③H2O2的化合物类型是________...