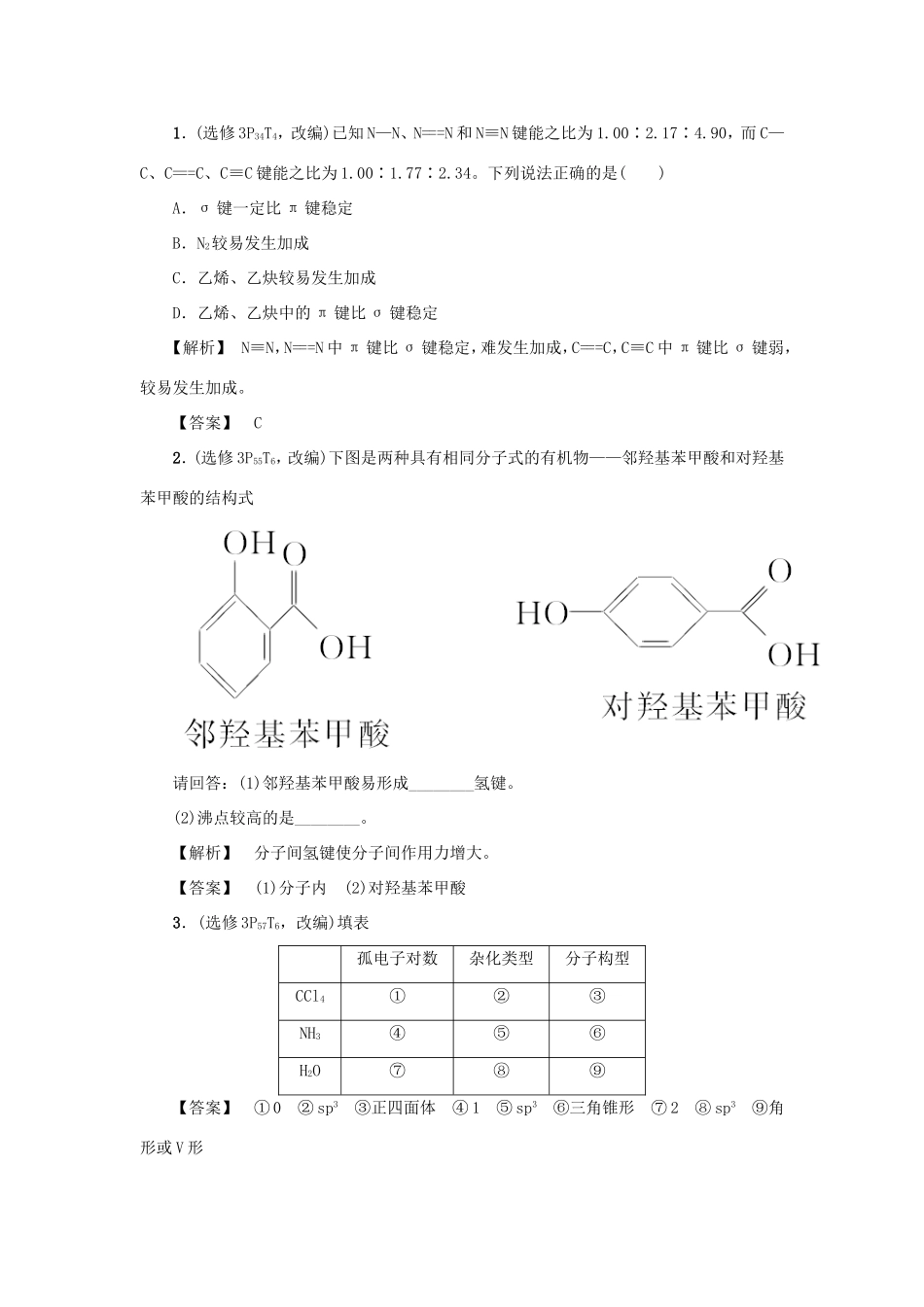
1.(选修3P34T4,改编)已知N—N、N===N和N≡N键能之比为1.00∶2.17∶4.90,而C—C、C===C、C≡C键能之比为1.00∶1.77∶2.34。下列说法正确的是()A.σ键一定比π键稳定B.N2较易发生加成C.乙烯、乙炔较易发生加成D.乙烯、乙炔中的π键比σ键稳定【解析】N≡N,N===N中π键比σ键稳定,难发生加成,C===C,C≡C中π键比σ键弱,较易发生加成。【答案】C2.(选修3P55T6,改编)下图是两种具有相同分子式的有机物——邻羟基苯甲酸和对羟基苯甲酸的结构式请回答:(1)邻羟基苯甲酸易形成________氢键。(2)沸点较高的是________。【解析】分子间氢键使分子间作用力增大。【答案】(1)分子内(2)对羟基苯甲酸3.(选修3P57T6,改编)填表孤电子对数杂化类型分子构型CCl4①②③NH3④⑤⑥H2O⑦⑧⑨【答案】①0②sp3③正四面体④1⑤sp3⑥三角锥形⑦2⑧sp3⑨角形或V形B组高考题组4.(双选)(2013·海南高考)下列化合物中,含有非极性共价键的离子化合物是()A.CaC2B.N2H4C.Na2S2D.NH4NO3【解析】N2H4为共价化合物,NH4NO3中不含非极性键。【答案】AC5.(2013·安徽高考)我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2――→CO2+H2O。下列有关说法正确的是()A.该反应为吸热反应B.CO2分子中的化学键为非极性键C.HCHO分子中既含σ键又含π键D.每生成1.8gH2O消耗2.24LO2【解析】A.通过分析化学方程式可知,该反应等同于甲醛的燃烧,属于放热反应。B.CO2的结构式为O===C===O,可见CO2中的共价键是由不同元素的原子形成的,属于极性键。C.甲醛中碳原子采取sp2杂化,有三个等同的sp2杂化轨道伸向平面三角形的三个顶点,分别形成3个σ键,一个未参加杂化的p轨道与O原子的2p轨道形成π键。D.根据题给化学方程式可知,每生成1.8g水消耗0.1mol氧气,但由于题中并没有给出温度和压强,所以不能确定氧气的体积一定为2.24L。【答案】C6.(2013·浙江自选)关于化合物,下列叙述正确的是()A.分子间可形成氢键B.分子中既有极性键又有非极性键C.分子中有7个σ键和1个π键D.该分子在水中的溶解度大于2丁烯【解析】该有机物分子中含有—CHO,含有电负性较强的O原子,但不含与电负性较强的原子相连的H原子,因此不易形成分子间氢键,A项错。该有机物分子中含有C—H、C=O极性键,C—C、C=C非极性键,B项对。该有机物分子中含有9个σ键和3个π键,C项错。该有机物分子易与水分子形成分子间氢键,而2丁烯则不能,故该有机物在水中的溶解度大于2丁烯,D项对。【答案】BD