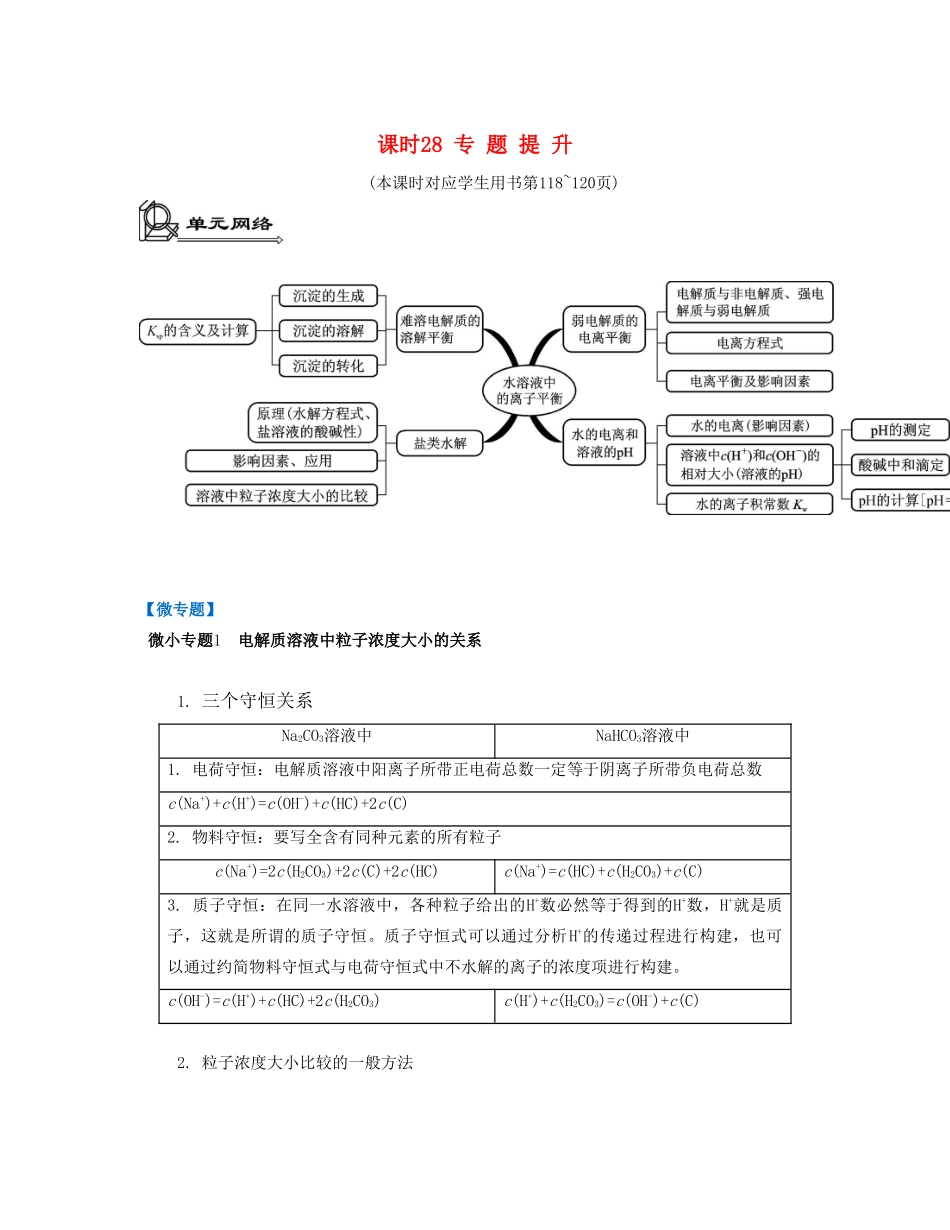
课时28专题提升(本课时对应学生用书第118~120页)【微专题】微小专题1电解质溶液中粒子浓度大小的关系1.三个守恒关系Na2CO3溶液中NaHCO3溶液中1.电荷守恒:电解质溶液中阳离子所带正电荷总数一定等于阴离子所带负电荷总数c(Na+)+c(H+)=c(OH-)+c(HC)+2c(C)2.物料守恒:要写全含有同种元素的所有粒子c(Na+)=2c(H2CO3)+2c(C)+2c(HC)c(Na+)=c(HC)+c(H2CO3)+c(C)3.质子守恒:在同一水溶液中,各种粒子给出的H+数必然等于得到的H+数,H+就是质子,这就是所谓的质子守恒。质子守恒式可以通过分析H+的传递过程进行构建,也可以通过约简物料守恒式与电荷守恒式中不水解的离子的浓度项进行构建。c(OH-)=c(H+)+c(HC)+2c(H2CO3)c(H+)+c(H2CO3)=c(OH-)+c(C)2.粒子浓度大小比较的一般方法(1)单一溶液中各种粒子浓度的相对大小酸或碱只考虑电离(微弱),多元弱酸的电离分步进行并逐级减弱。①CH3COOH溶液中:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)②H2CO3溶液中:c(H2CO3)>c(H+)>c(HC)>c(OH-)③氨水中:c(NH3·H2O)>c(OH-)>c(N)>c(H+)正盐只考虑水解(微弱)。①CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)②NH4Cl溶液中:c(Cl-)>c(N)>c(H+)>c(NH3·H2O)>c(OH-)③Na2CO3溶液中:c(Na+)>c(C)>c(OH-)>c(HC)>c(H+)酸式盐既要考虑电离又要考虑水解。①NaHCO3溶液中(溶液呈碱性说明水解程度大于电离程度):c(Na+)>c(HC)>c(OH-)>c(H+)c(Na+)>c(HC)>c(H2CO3)>c(C)②NaHSO3溶液中(溶液呈酸性说明电离程度大于水解程度):c(Na+)>c(HS)>c(H+)>c(S)>c(OH-)c(Na+)>c(HS)>c(S)>c(H2SO3)(2)两种混合物质的离(粒)子浓度大小及浓度关系若酸与碱恰好完全反应,则相当于一种盐溶液。若酸与碱反应后尚有弱酸或弱碱剩余,则要考虑弱电解质的电离程度与盐的水解程度的大小关系。①等浓度的CH3COOH和CH3COONa溶液(溶液呈酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度):c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)②等浓度的NH4Cl和NH3·H2O溶液(溶液呈碱性,说明NH3·H2O的电离程度大于N的水解程度):c(N)>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)③等浓度的NaCN和HCN溶液(溶液呈碱性,说明CN-的水解程度大于HCN的电离程度):c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+)3.影响离子水解的因素(1)同种(电性同)离子抑制水解,异种(电性不同)离子促进水解,强酸阴离子和强碱阳离子不影响水解①浓度均为0.1mol·L-1的(NH4)2CO3、(NH4)2SO4、(NH4)2Fe(SO4)2溶液中,c(N)的大小顺序:(NH4)2Fe(SO4)2>(NH4)2SO4>(NH4)2CO3(Fe2+水解抑制了N的水解,C水解促进了N的水解,S不影响N的水解)②c(N)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系:c[(NH4)2Fe(SO4)2]