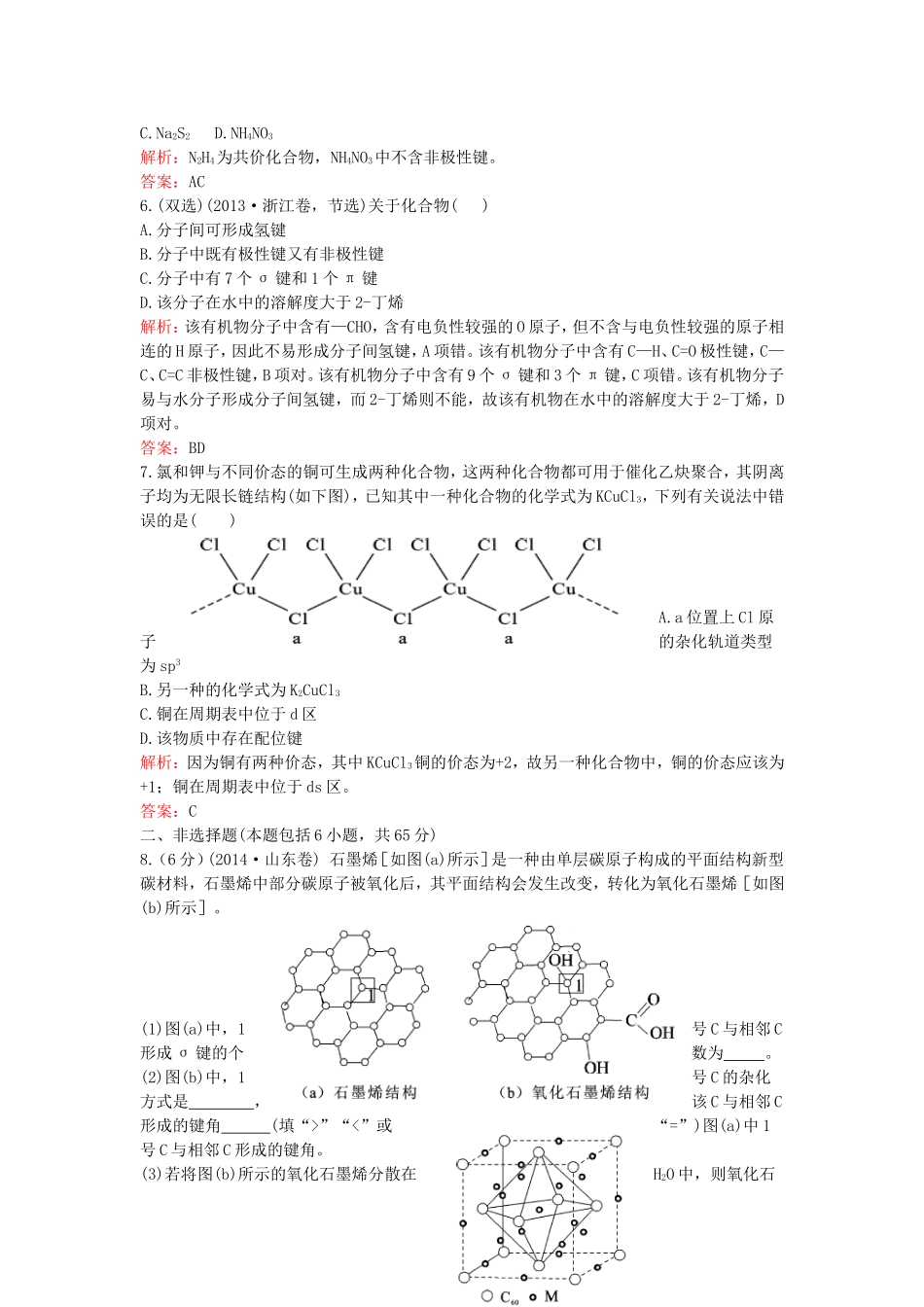
第十二章物质的结构与性质单元过关检测一、选择题(本题包括7小题,每小题5分,共35分)1.(2014·安徽卷)CO2的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应:下列有关三聚氰酸的说法正确的是()A.分子式为C3H6N3O3B.分子中既含有极性键,也含有非极性键C.属于共价化合物D.生成该物质的上述反应为中和反应解析:根据三聚氰酸的结构简式,可知其分子式为C3H3N3O3,A错误;B.根据原子间的连接方式可知,三聚氰酸中只有极性键,B错误;C.根据三聚氰酸的组成可知其属于共价化合物,C正确;D.NH3不属于碱,CO2不属于酸,所以该反应不属于酸碱中和反应。答案:C2.(双选)(2014·海南卷)对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是()A.SiX4难水解B.SiX4是共价化合物C.NaX易水解D.NaX的熔点一般高于SiX4解析:SiX4易水解,但NaX中除NaF外,NaCl,NaBr,NaI都不水解;因为SiX4是共价化合物,通常为分子晶体,而NaX是离子化合物,是离子晶体,所以NaX的熔点一般高于SiX4。答案:BD3.氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。下列关于氯化亚砜分子的几何构型和中心原子(S)采取杂化方式的说法正确的是()A.三角锥形、sp3B.V形、sp2C.平面三角形、sp2D.三角锥形、sp2解析:SOCl2分子中S原子的杂化轨道数为1+3=4,S原子采取sp3杂化,由于孤电子对占据一个杂化轨道,分子构型为三角锥形。答案:A4.(2015·东北师大附中模拟)化合物NH3与BF3可以通过配位键形成NH3·BF3,下列说法正确的是()A.NH3与BF3都是三角锥形B.NH3与BF3都是极性分子C.NH3·BF3中各原子都达到8电子稳定结构D.NH3·BF3中,NH3提供孤电子对,BF3提供空轨道解析:NH3是三角锥形,而BF3是平面三角形结构,B位于中心,因此,NH3是极性分子,但BF3是非极性分子,A、B都不对;NH3分子中有1对孤电子对,BF3中B原子最外层只有6个电子,正好有1个空轨道,二者通过配位键结合而使它们都达到稳定结构,D正确;但H原子核外只有2个电子,C是错误的。答案:D5.(双选)(2013·海南卷)下列化合物中,含有非极性共价键的离子化合物是()A.CaC2B.N2H4C.Na2S2D.NH4NO3解析:N2H4为共价化合物,NH4NO3中不含非极性键。答案:AC6.(双选)(2013·浙江卷,节选)关于化合物()A.分子间可形成氢键B.分子中既有极性键又有非极性键C.分子中有7个σ键和1个π键D.该分子在水中的溶解度大于2-丁烯解析:该有机物分子中含有—CHO,含有电负性较强的O原子,但不含与电负性较强的原子相连的H原子,因此不易形成分子间氢键,A项错。该有机物分子中含有C—H、C=O极性键,C—C、C=C非极性键,B项对。该有机物分子中含有9个σ键和3个π键,C项错。该有机物分子易与水分子形成分子间氢键,而2-丁烯则不能,故该有机物在水中的溶解度大于2-丁烯,D项对。答案:BD7.氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如下图),已知其中一种化合物的化学式为KCuCl3,下列有关说法中错误的是()A.a位置上Cl原子的杂化轨道类型为sp3B.另一种的化学式为K2CuCl3C.铜在周期表中位于d区D.该物质中存在配位键解析:因为铜有两种价态,其中KCuCl3铜的价态为+2,故另一种化合物中,铜的价态应该为+1;铜在周期表中位于ds区。答案:C二、非选择题(本题包括6小题,共65分)8.(6分)(2014·山东卷)石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示]。(1)图(a)中,1号C与相邻C形成σ键的个数为。(2)图(b)中,1号C的杂化方式是,该C与相邻C形成的键角(填“>”“<”或“=”)图(a)中1号C与相邻C形成的键角。(3)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有(填元素符号)。(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如上图所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为,该材料的化学式为。解析:(1)由图(a)可知,1号C与另外3个碳原子形成3个σ键。(2)图(b)中1号C与3...