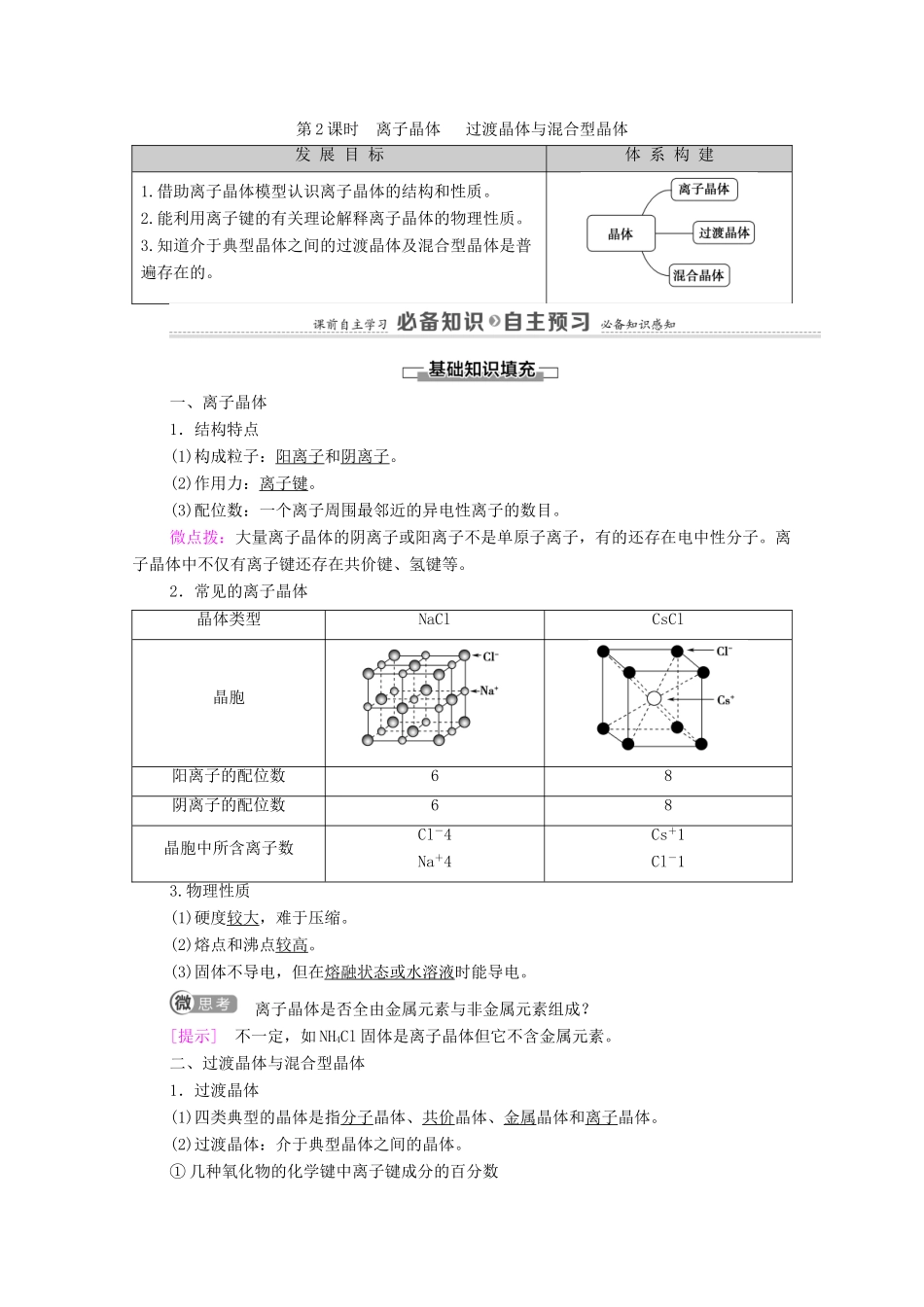
第2课时离子晶体过渡晶体与混合型晶体发展目标体系构建1.借助离子晶体模型认识离子晶体的结构和性质。2.能利用离子键的有关理论解释离子晶体的物理性质。3.知道介于典型晶体之间的过渡晶体及混合型晶体是普遍存在的。一、离子晶体1.结构特点(1)构成粒子:阳离子和阴离子。(2)作用力:离子键。(3)配位数:一个离子周围最邻近的异电性离子的数目。微点拨:大量离子晶体的阴离子或阳离子不是单原子离子,有的还存在电中性分子。离子晶体中不仅有离子键还存在共价键、氢键等。2.常见的离子晶体晶体类型NaClCsCl晶胞阳离子的配位数68阴离子的配位数68晶胞中所含离子数Cl-4Na+4Cs+1Cl-13.物理性质(1)硬度较大,难于压缩。(2)熔点和沸点较高。(3)固体不导电,但在熔融状态或水溶液时能导电。离子晶体是否全由金属元素与非金属元素组成?[提示]不一定,如NH4Cl固体是离子晶体但它不含金属元素。二、过渡晶体与混合型晶体1.过渡晶体(1)四类典型的晶体是指分子晶体、共价晶体、金属晶体和离子晶体。(2)过渡晶体:介于典型晶体之间的晶体。①几种氧化物的化学键中离子键成分的百分数氧化物Na2OMgOAl2O3SiO2离子键的百分数/%62504133从上表可知,表中4种氧化物晶体中的化学键既不是纯粹的离子键,也不是纯粹的共价键,这些晶体既不是纯粹的离子晶体也不是纯粹的共价晶体,只是离子晶体与共价晶体之间的过渡晶体。②偏向离子晶体的过渡晶体在许多性质上与纯粹的离子晶体接近,因而通常当作离子晶体来处理,如Na2O等。同样,偏向共价晶体的过渡晶体则当作共价晶体来处理,如Al2O3、SiO2等。微点拨:四类典型晶体都有过渡晶体存在。2.混合型晶体(1)晶体模型石墨结构中未参与杂化的p轨道(2)结构特点——层状结构①同层内碳原子采取sp2杂化,以共价键(σ键)结合,形成平面六元并环结构。②层与层之间靠范德华力维系。③石墨的二维结构内,每个碳原子的配位数为3,有一个未参与杂化的2p电子,它的原子轨道垂直于碳原子平面。(3)晶体类型:石墨晶体中,既有共价键,又有金属键和范德华力,属于混合晶体。(4)性质:熔点很高、质软、易导电等。微点拨:石墨为什么具有良好的导电性?提示:由于碳原子的p轨道相互平行且相互重叠,p轨道中的电子可在整个碳原子平面中运动,所以石墨具有导电性。1.判断正误(对的在括号内打“√”,错的在括号内打“×”。)(1)金属晶体和离子晶体的导电实质是一样的(×)(2)固态不导电、水溶液能导电,这一性质能说明某晶体一定是离子晶体(×)(3)Al2O3含有金属元素,属于离子晶体(×)(4)石墨为混合晶体,因层间存在分子间作用力,故熔点低于金刚石。(×)2.离子晶体一般不具有的特征是()A.熔点较高,硬度较大B.易溶于水而难溶于有机溶剂C.固体时不能导电D.离子间距离较大,其密度较大D[离子晶体的结构决定着离子晶体具有一系列特性,这些特性包括A、B、C项所述。]3.下列7种物质:①白磷(P4);②水晶;③氯化铵;④氢氧化钙;⑤氟化钠;⑥过氧化钠;⑦石墨。固态下都为晶体,回答下列问题(填写序号):(1)不含金属离子的离子晶体是________,只含离子键的离子晶体是________,既有离子键又有非极性键的离子晶体是________,既有离子键又有极性键的离子晶体是________。(2)既含范德华力,又有非极性键的晶体是________,熔化时既要克服范德华力,又要破坏化学键的是________,熔化时只破坏共价键的是________。[答案](1)③⑤⑥③④(2)①⑦⑦②离子晶体的结构与性质离子化合物在我们周围比比皆是。常温下,许多离子化合物都是以晶体形态存在的。(1)含金属阳离子的晶体一定是离子晶体吗?有阳离子的晶体中一定存在阴离子吗?提示:不一定。也可能是金属晶体;晶体中含有阳离子,不一定存在阴离子,如金属晶体由阳离子和自由电子构成。(2)离子晶体中一定含有金属元素吗?由金属元素和非金属元素组成的晶体一定是离子晶体吗?提示:不一定。离子晶体中不一定含金属元素,如NH4Cl、NH4NO3等铵盐。由金属元素和非金属元素组成的晶体不一定是离子晶体,如AlCl3是分子晶体。(3)离子晶体的熔点一定低于共价晶体吗?提示:不一定。离子晶体的熔点不一定低于共价晶体,如MgO是...