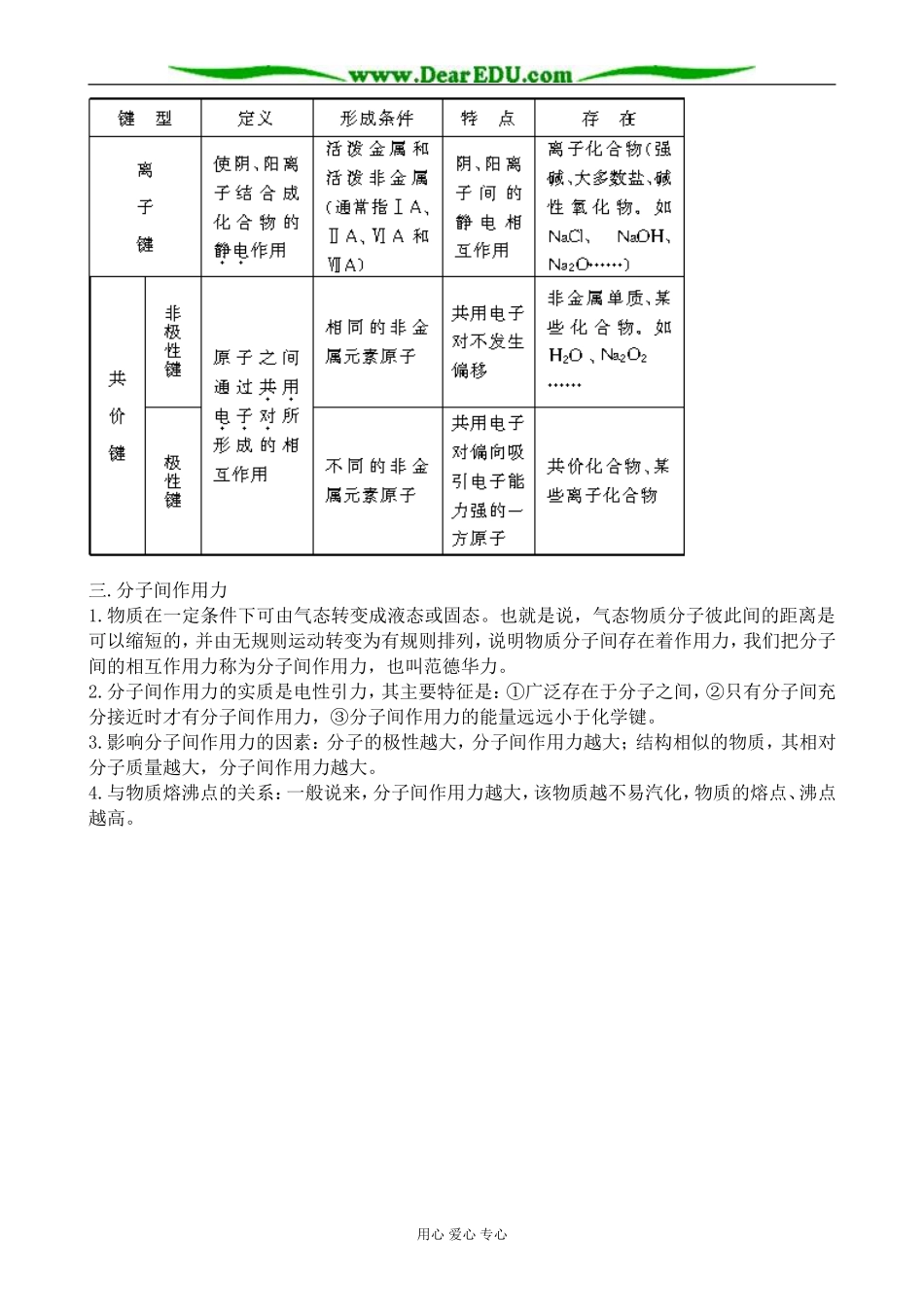
微观之间的的相互作用力微粒之间的相互作用力离子键1课时共价键分子间作用力1课时1课时一.离子键书写原子、离子、分子和离子化合物的电子式时要注意的问题电子式是表示物质结构的一种式子。其写法是在元素符号的周围用小黑点或×等表示原子或离子的最外层电子,并用n+或n-(n为正整数)表示离子所带电荷。书写时要注意以下几点:1.要根据原子或离子的最外层电子排布式写。如镁原子最外层两个s电子是已配对的,应写为Mg,不能写成:×Mg×。又如氮原子的最外层电子排布式为2s22px12py12pz1,三个2p电子是未配对的,应写为,而不能写成。2.主族元素的简单离子中,阳离子的电子式就是其离子符号。如Mg2+既是镁离子符号,也是镁离子的电子式。阴离子的最外层都是8电子结构,要表示出原子原来的电子与获得的电子的区别;在表示电子的符号外加方括号,方括号的右上角标明所带电荷。如S2-的电子式为:,Cl-的电子式为。3.离子化合物中阴阳离子个数比不是1∶1时,要注意每一个离子都与带相反电荷的离子直接相邻的事实。如MgCl2的电子式写为或。多原子共价化合物的电子式也应体现出各原子的排列,如HClO的电子式写作4.写双原子分子的非金属单质的电子式时,要注意共用电子对的数目和表示方法。如N2的电子式应为不能写成更不能写成更不能写成5.要注意共价化合物与离子化合物电子式的区别。前者不加括号,不写表示电荷的符号,后者的复杂离子加方括号,括号外写表示电荷的符号。前者的共用电子对一般还要求表示出其组成电子来源于哪一原子。如H2O的电子式为,不能写成,最好不要写成。又如H2O2的电子式为的电子式为6.电子式只要求表示出化学键的情况,并不要求表示出分子的形状。如H2O和H2S的电子式不要求写成:来表示构型。7.中学阶段,并非所有的物质都可以用电子式来表示其结构的。如CO、O3等。二.共价键用心爱心专心三.分子间作用力1.物质在一定条件下可由气态转变成液态或固态。也就是说,气态物质分子彼此间的距离是可以缩短的,并由无规则运动转变为有规则排列,说明物质分子间存在着作用力,我们把分子间的相互作用力称为分子间作用力,也叫范德华力。2.分子间作用力的实质是电性引力,其主要特征是:①广泛存在于分子之间,②只有分子间充分接近时才有分子间作用力,③分子间作用力的能量远远小于化学键。3.影响分子间作用力的因素:分子的极性越大,分子间作用力越大;结构相似的物质,其相对分子质量越大,分子间作用力越大。4.与物质熔沸点的关系:一般说来,分子间作用力越大,该物质越不易汽化,物质的熔点、沸点越高。用心爱心专心