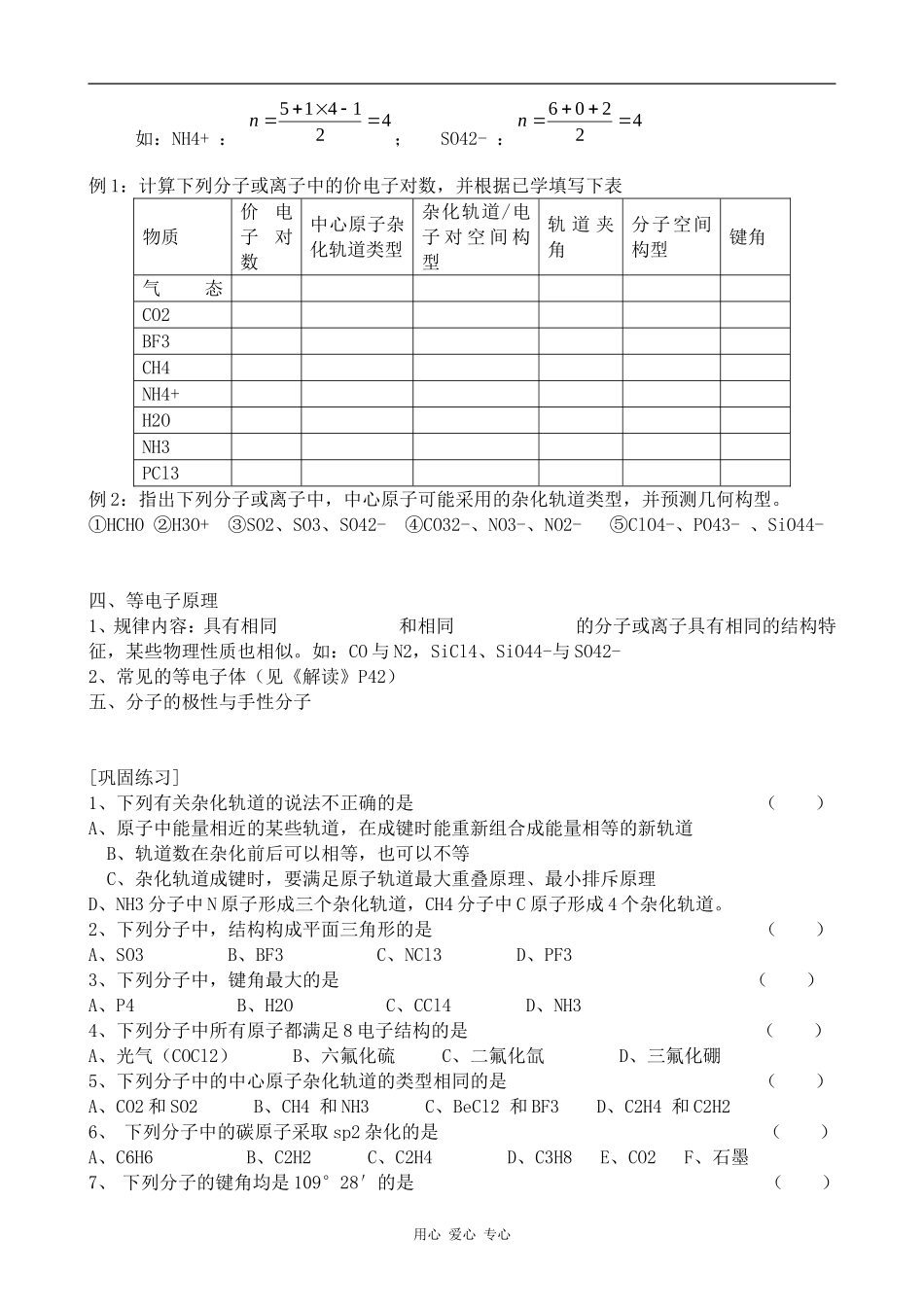
分子的空间结构[知识点回顾]一、杂化轨道理论(1)能量相近的原子轨道才能参与杂化;(2)杂化后的轨道一头大,一头小,电子云密度大的一端与成键原子的原子轨道沿键轴方向重叠,形成σ键;由于杂化后原子轨道重叠更大,形成的共价键比原有原子轨道形成的共价键稳定。(3)杂化轨道能量相同,成分相同,如:每个sp3杂化轨道占有个s轨道、个p轨道;(4)杂化轨道总数等参与杂化的原子轨道数目之和。sp3杂化(举例:)sp2杂化(举例:)sp杂化:(举例:)二、价层电子对互斥理论1、价电子对:包括孤对电子对和成键电子对,一般孤对电子对离核较近。2、价电子对之间存在相互排斥作用,为减小斥力,相互之间尽可能远离,因此分子的空间构型受到影响,一般,分子尽可能采取对称的空间结构以减小斥力。相邻电子对间斥力大小顺序:孤对电子对孤对电子对>孤对电子对成键电子对>成键电子对成键电子对三、确定分子空间构型的简易方法1、对于ABm型分子(1)对于主族元素,中心原子价电子数=最外层电子数,配位原子按提供的价电子数计算,如:PCl5中52515n(2)O、S作为配位原子时按不提供价电子计算,作中心原子时价电子数为6;(3)离子的价电子对数计算用心爱心专心如:NH4+:421415n;SO42-:42206n例1:计算下列分子或离子中的价电子对数,并根据已学填写下表物质价电子对数中心原子杂化轨道类型杂化轨道/电子对空间构型轨道夹角分子空间构型键角气态BeCl2CO2BF3CH4NH4+H2ONH3PCl3例2:指出下列分子或离子中,中心原子可能采用的杂化轨道类型,并预测几何构型。①HCHO②H3O+③SO2、SO3、SO42-④CO32-、NO3-、NO2-⑤ClO4-、PO43-、SiO44-四、等电子原理1、规律内容:具有相同和相同的分子或离子具有相同的结构特征,某些物理性质也相似。如:CO与N2,SiCl4、SiO44-与SO42-2、常见的等电子体(见《解读》P42)五、分子的极性与手性分子[巩固练习]1、下列有关杂化轨道的说法不正确的是()A、原子中能量相近的某些轨道,在成键时能重新组合成能量相等的新轨道B、轨道数在杂化前后可以相等,也可以不等C、杂化轨道成键时,要满足原子轨道最大重叠原理、最小排斥原理D、NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。2、下列分子中,结构构成平面三角形的是()A、SO3B、BF3C、NCl3D、PF33、下列分子中,键角最大的是()A、P4B、H2OC、CCl4D、NH34、下列分子中所有原子都满足8电子结构的是()A、光气(COCl2)B、六氟化硫C、二氟化氙D、三氟化硼5、下列分子中的中心原子杂化轨道的类型相同的是()A、CO2和SO2B、CH4和NH3C、BeCl2和BF3D、C2H4和C2H26、下列分子中的碳原子采取sp2杂化的是()A、C6H6B、C2H2C、C2H4D、C3H8E、CO2F、石墨7、下列分子的键角均是109°28′的是()用心爱心专心A、P4B、NH3C、CCl4D、CH2Cl28、有关苯分子中的化学键描述正确的是()A.每个碳原子的sp2杂化轨道中的其中一个形成大π键B.每个碳原子的未参加杂化的2p轨道形成大π键C.碳原子的三个sp2杂化轨道与其它形成三个σ键D.碳原子的未参加杂化的2p轨道与其它形成σ键9、下列判断正确的是()A、BF3是三角锥形分子B、铵根离子呈平面形结构C、甲烷分子中的4个C-H键都是氢原子的1s轨道与碳原子的p轨道形成的s-pσ键D、甲烷分子中的4个C-H键都是氢原子的1s轨道与碳原子的4个sp3杂化轨道重叠形成的σ键10、B3N3H6和苯就是等电子体,人们把B3N3H6称作无机苯,下列说法中正确的是()A、B3N3H6是由极性键组成的非极性分子B、B3N3H6能发生加成反应和取代反应C、B3N3H6具有碱性D、B3N3H6各原子不在同一个平面上E、B3N3H6中B和N原子的原子轨道可能采取sp2型杂化11、下列说法中不正确的是()A、分子中的价电子对(包括成键电子对和孤电子对)之间存在相互排斥作用B、分子中的价电子对之间趋向于彼此远离C、分子在很多情况下并不是尽可能采取对称的空间构型D、当价电子对数目分别是2、3、4时,价电子对分布的几何构型分别为直线型、平面三角型、正四面体型12、成键原子中的孤电子对对键能有影响,孤电子对的排斥作用使得键能变小。第2周期元素A与氢形成的化合物...