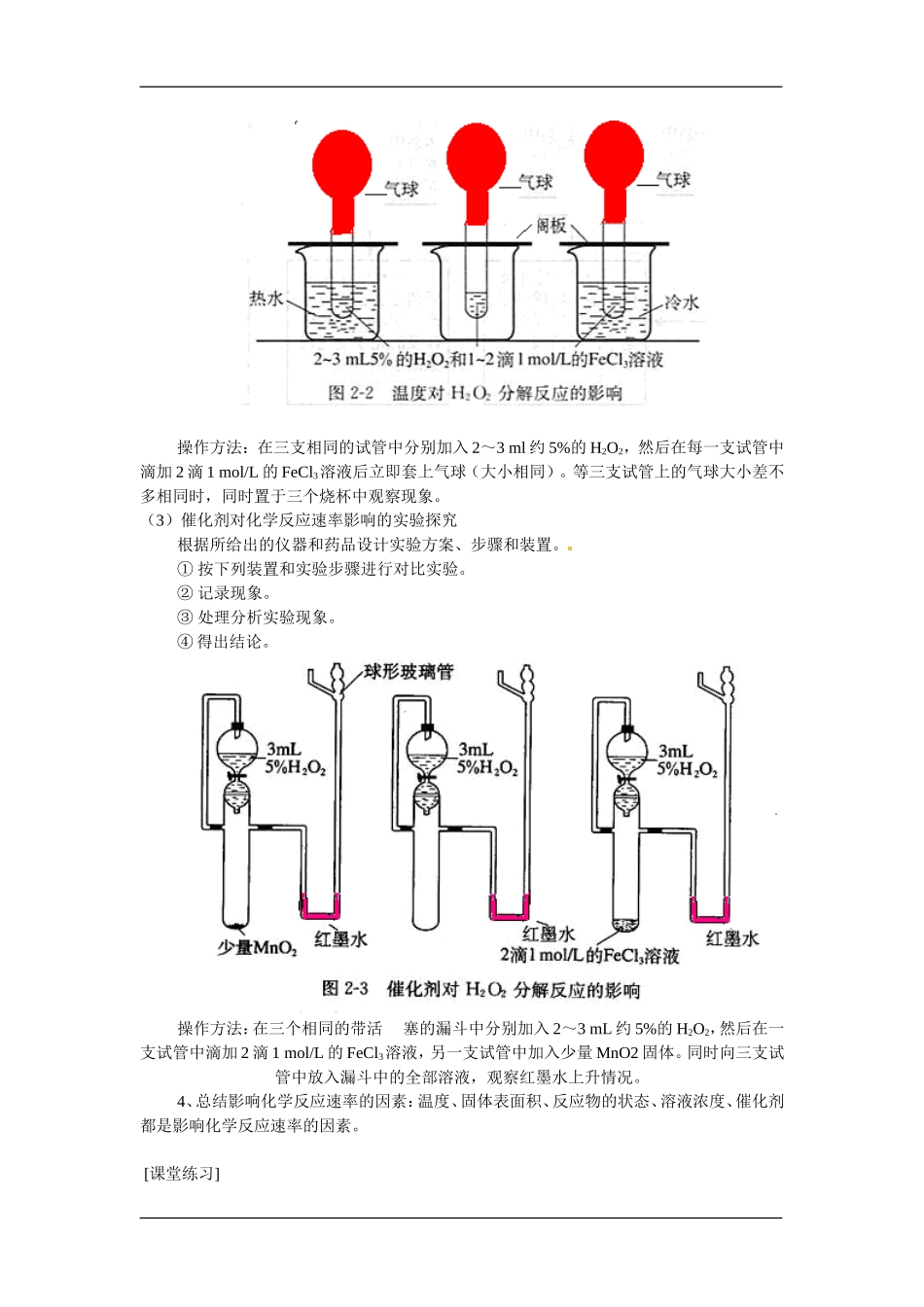
第一单元化学反应速率与反应限度第一课时学习目标1.知道化学反应速率和反应限度概念2.知道化学反应限度的本质原因及外部特征3.了解影响化学反应速率和反应限度的因素教学重难点:化学反应速率和反应限度概念;了解影响化学反应速率和反应限度的因素。化学反应限度的本质原因及外部特征教学过程:【引言】在前面两节中,我们着重探讨化学能向其他形式的能量(如热能和电能)的转化,并指出化学反应中的物质变化及伴随发生的能量变化是化学反应的两大基本特征。今天我们则要从另一个角度研究化学反应,探讨人类面对具体的化学反应要考虑的两个基本问题:外界条件对化学反应速率和反应限度的影响。人类如何利用和控制化学反应,如提高燃料的利用率,必须了解这些问题。【新课】第一节化学反应的速率和限度一、化学反应的速率日常生活中的化学变化有快有慢。有的反应瞬间完成,如爆炸;有的化学反应要经历几万年以上,如化石燃料的形成和溶洞的形成;有的反应在高温条件下变化快,在低温的条件下变化慢,如食品的变质;还有的反应在干燥的环境中变化慢,在潮湿的环境下变化快,如钢铁的锈蚀。人们在实验室进行化学反应时,常常采用粉碎反应物以增大其接触面积,或将固体反应物溶于水中以提高其接触机会,或加入催化剂等措施来提高化学应速率。我们知道汽车运行时有一定的速度,我们可以用Km/min来表示。那么化学反应速率又用什么来表示?1、反应速率的概念:表示化学反应进行快慢的物理量。(与物理上的速度加以区别)2、反应速率的表示方法:常依据反应物的消失(单位时间内反应物浓度的减小)或生成物的产生(单位时间内生成物浓度的增大)来表示。单位:mol/L.min或mol/L.sV=△c/△t△c:表示物质的量浓度的变化量。△t:表示时间的变化量例题分析:在一个容积为5L的密闭容器中进行可逆反应:4NH3(气)+5O2(气)4NO(气)+6H2O(气),3OS后,NO的物质的量增加了0.3mol,则此反应的平均速率Vx为()A、VO2=0.01mol/L(L·S)B、VNO=0.008mol/(L·S)C、VH2O=0.003mol/(L·S)D、VNH3=0.002mol/(L·S)分析:根据化学反应速率的概念,可先求出以NO的浓度变化表示的平均速率,然后依据化学方程式的系数关系再换算成其它反应物或生成物的平均速率。即:VNO=SLmol3053.0=0.002mol/(L·S)则:VNH3=VNO=0.002mol/(L·S)VO2=0.002mol/(L·S)×45=0.0025mol/(L·S)VH2O=0.002mol(L·S)×46=0.003mol/(L·S)答案:C、D。3、影响化学反应速率的因素(1)反应原理探究实验题目双氧水分解反应实验步骤在一支试管中加入2~3mL约5%的H2O2,然后滴加1~2滴1mol/L的FeCl3溶液待试管中产生大量气泡时,用带火星的火柴梗检验产生的气体实验现象有大量气泡产生木条复燃用化学方程式解释实验现象2H2O2=2H2O+O2↑思考问题寻找答案1.通过观察什么现象来判断该反应进行得快慢?2.还有哪些其他办法观察该化学反应速率?列出你对问题的想法(2)温度对化学反应速率影响的实验探究根据所给出的仪器和药品设计实验方案、步骤和装置。①按下列装置和实验步骤进行对比实验。②记录现象。③处理分析实验现象。④得出结论。操作方法:在三支相同的试管中分别加入2~3ml约5%的H2O2,然后在每一支试管中滴加2滴1mol/L的FeCl3溶液后立即套上气球(大小相同)。等三支试管上的气球大小差不多相同时,同时置于三个烧杯中观察现象。(3)催化剂对化学反应速率影响的实验探究根据所给出的仪器和药品设计实验方案、步骤和装置。①按下列装置和实验步骤进行对比实验。②记录现象。③处理分析实验现象。④得出结论。操作方法:在三个相同的带活塞的漏斗中分别加入2~3mL约5%的H2O2,然后在一支试管中滴加2滴1mol/L的FeCl3溶液,另一支试管中加入少量MnO2固体。同时向三支试管中放入漏斗中的全部溶液,观察红墨水上升情况。4、总结影响化学反应速率的因素:温度、固体表面积、反应物的状态、溶液浓度、催化剂都是影响化学反应速率的因素。[课堂练习]1、在一个容积为5L的密闭容器中进行可逆反应:4NH3(气)+5O2(气)4NO(气)+6H2O(气),3OS后,NO的物质的量增加了0.3mol,则此反应的平均速率Vx为()A、VO2=0.01mol/L(L·S)B、VNO=0.008...