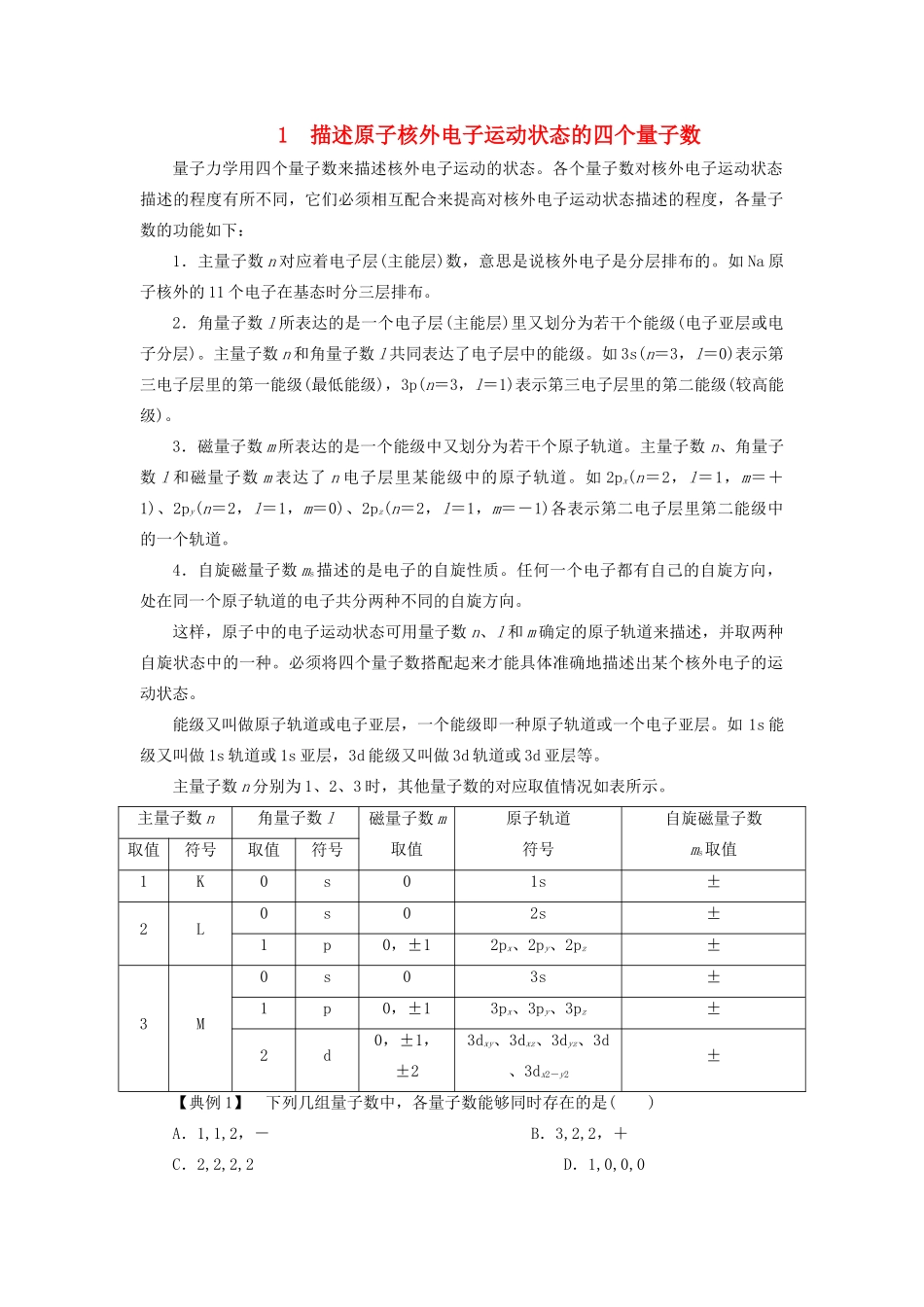
1描述原子核外电子运动状态的四个量子数量子力学用四个量子数来描述核外电子运动的状态。各个量子数对核外电子运动状态描述的程度有所不同,它们必须相互配合来提高对核外电子运动状态描述的程度,各量子数的功能如下:1.主量子数n对应着电子层(主能层)数,意思是说核外电子是分层排布的。如Na原子核外的11个电子在基态时分三层排布。2.角量子数l所表达的是一个电子层(主能层)里又划分为若干个能级(电子亚层或电子分层)。主量子数n和角量子数l共同表达了电子层中的能级。如3s(n=3,l=0)表示第三电子层里的第一能级(最低能级),3p(n=3,l=1)表示第三电子层里的第二能级(较高能级)。3.磁量子数m所表达的是一个能级中又划分为若干个原子轨道。主量子数n、角量子数l和磁量子数m表达了n电子层里某能级中的原子轨道。如2px(n=2,l=1,m=+1)、2py(n=2,l=1,m=0)、2pz(n=2,l=1,m=-1)各表示第二电子层里第二能级中的一个轨道。4.自旋磁量子数ms描述的是电子的自旋性质。任何一个电子都有自己的自旋方向,处在同一个原子轨道的电子共分两种不同的自旋方向。这样,原子中的电子运动状态可用量子数n、l和m确定的原子轨道来描述,并取两种自旋状态中的一种。必须将四个量子数搭配起来才能具体准确地描述出某个核外电子的运动状态。能级又叫做原子轨道或电子亚层,一个能级即一种原子轨道或一个电子亚层。如1s能级又叫做1s轨道或1s亚层,3d能级又叫做3d轨道或3d亚层等。主量子数n分别为1、2、3时,其他量子数的对应取值情况如表所示。主量子数n角量子数l磁量子数m取值原子轨道符号自旋磁量子数ms取值取值符号取值符号1K0s01s±2L0s02s±1p0,±12px、2py、2pz±3M0s03s±1p0,±13px、3py、3pz±2d0,±1,±23dxy、3dxz、3dyz、3d、3dx2-y2±【典例1】下列几组量子数中,各量子数能够同时存在的是()A.1,1,2,-B.3,2,2,+C.2,2,2,2D.1,0,0,0解析在A中,n=1,l=1,m=2,ms=-不合理;在B中,n=3,l=2,m=2,ms=+合理;在C中,n=2,l=2,m=2,ms=2不合理;在D中,n=1,l=0,m=0,ms=0不合理。答案B