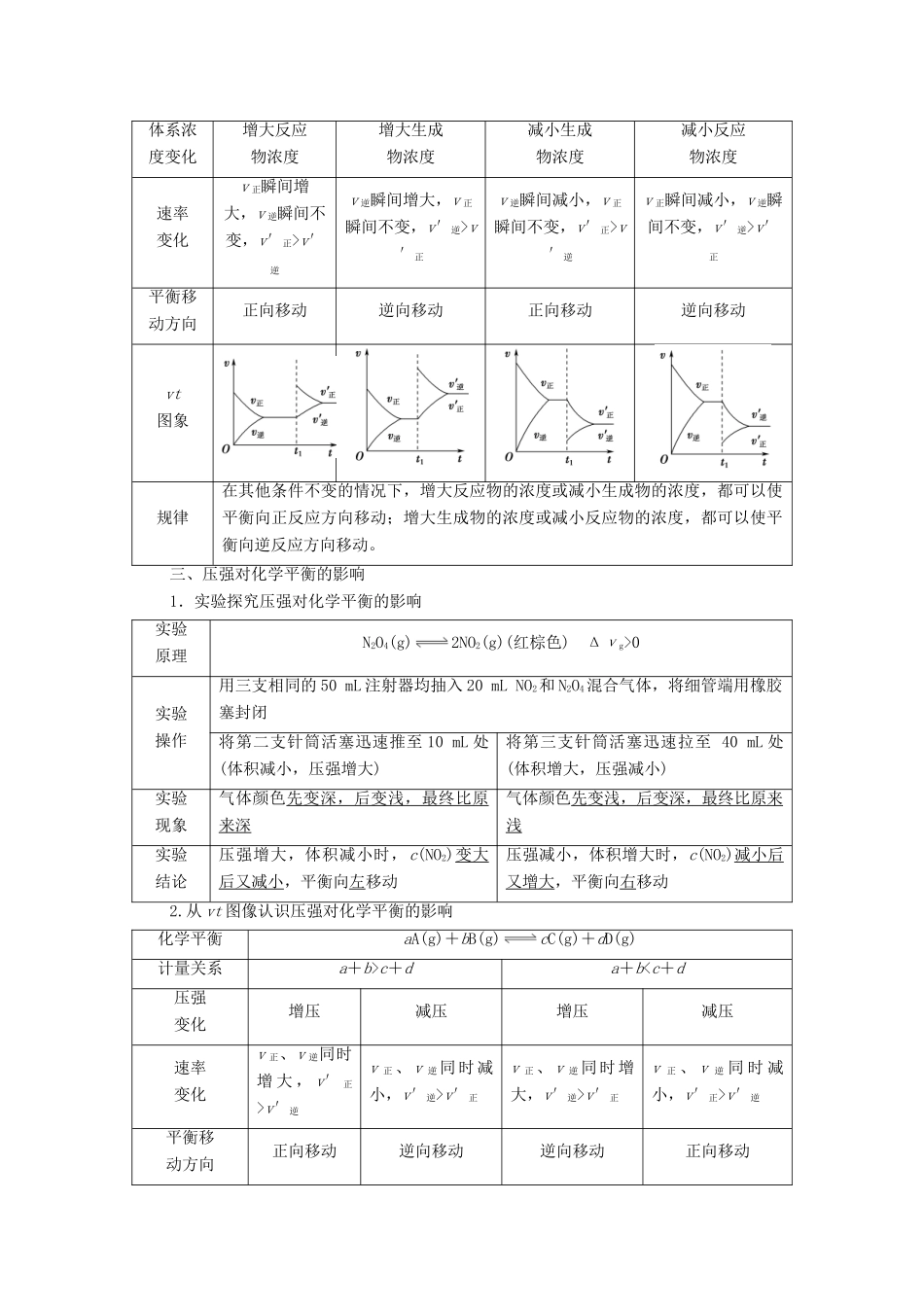
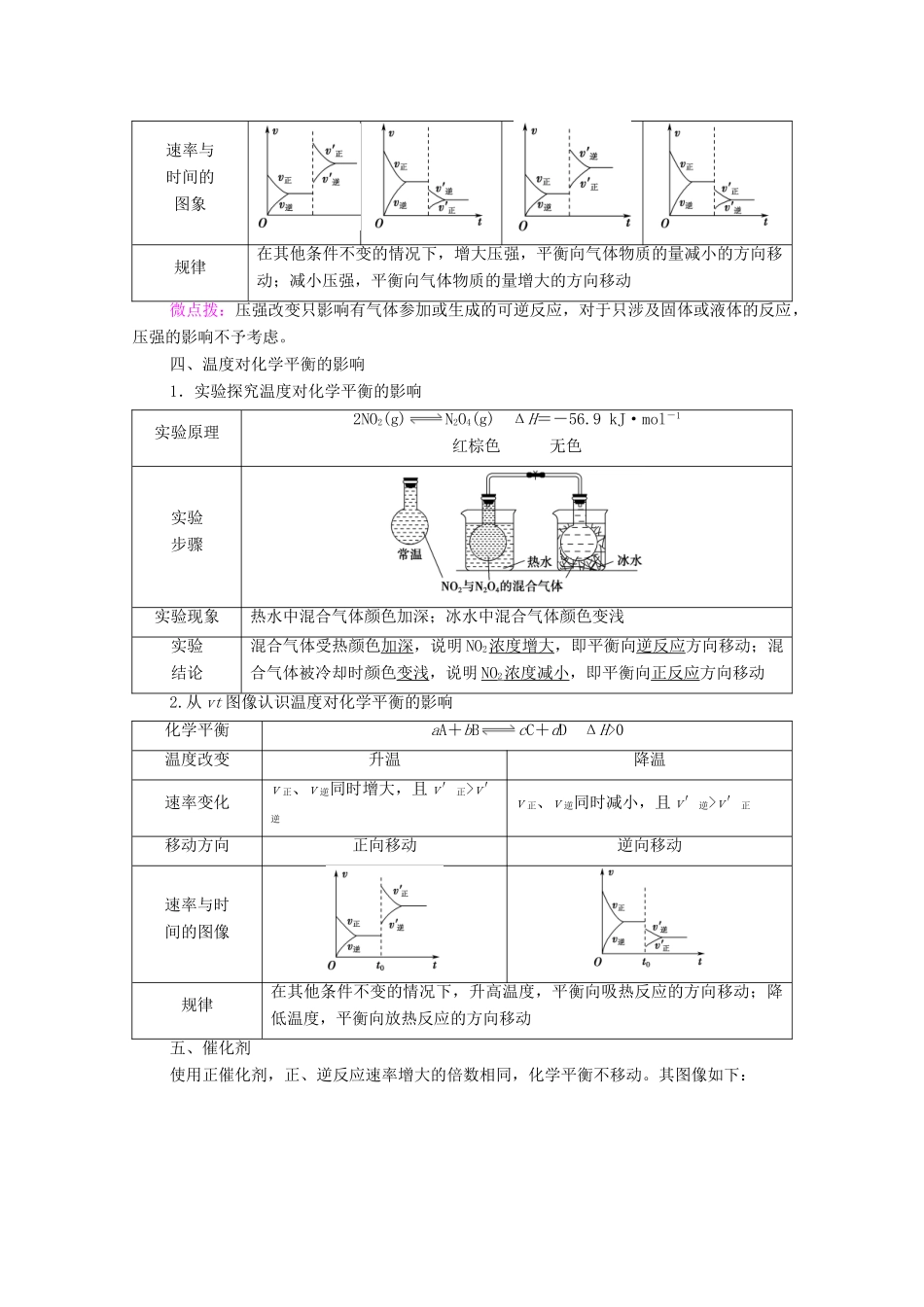
第2课时影响化学平衡的因素发展目标体系构建1.通过实验探究,了解温度、浓度、压强和催化剂对化学平衡状态的影响。2.学会用图示的方法表示在可逆反应中正逆反应速率随外界条件的变化,并分析平衡移动的方向。一、化学平衡移动1.含义:在一定条件下,当一个可逆反应达到化学平衡状态后,如果改变浓度、温度、压强等外界条件,原来的平衡状态会被破坏,化学平衡会发生移动,在一段时间后达到新的平衡状态。2.实质:改变条件后:(1)v正≠v逆。(2)各组分的百分含量发生改变。3.图示二、浓度对化学平衡的影响1.实验探究浓度对化学平衡的影响原理Fe3++3SCN-Fe(SCN)3浅黄色无色红色实验步骤现象a试管中溶液呈红色,b试管溶液红色变浅,c试管中溶液红色变深实验结论增大c(Fe3+)或c(SCN-)后,化学平衡均向正反应方向移动,Fe(SCN)3的浓度均增大,溶液红色加深;滴加少量铁粉,由于Fe+2Fe3+===3Fe2+,使Fe3+的浓度减小,化学平衡向逆反应方向移动,Fe(SCN)3的浓度减小,溶液红色变浅。2.从vt图像认识浓度对平衡的影响化学平衡aA+bBcC+dD(A、B、C、D为非固体)体系浓度变化增大反应物浓度增大生成物浓度减小生成物浓度减小反应物浓度速率变化v正瞬间增大,v逆瞬间不变,v′正>v′逆v逆瞬间增大,v正瞬间不变,v′逆>v′正v逆瞬间减小,v正瞬间不变,v′正>v′逆v正瞬间减小,v逆瞬间不变,v′逆>v′正平衡移动方向正向移动逆向移动正向移动逆向移动vt图象规律在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使平衡向正反应方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向逆反应方向移动。三、压强对化学平衡的影响1.实验探究压强对化学平衡的影响实验原理N2O4(g)2NO2(g)(红棕色)Δνg>0实验操作用三支相同的50mL注射器均抽入20mLNO2和N2O4混合气体,将细管端用橡胶塞封闭将第二支针筒活塞迅速推至10mL处(体积减小,压强增大)将第三支针筒活塞迅速拉至40mL处(体积增大,压强减小)实验现象气体颜色先变深,后变浅,最终比原来深气体颜色先变浅,后变深,最终比原来浅实验结论压强增大,体积减小时,c(NO2)变大后又减小,平衡向左移动压强减小,体积增大时,c(NO2)减小后又增大,平衡向右移动2.从vt图像认识压强对化学平衡的影响化学平衡aA(g)+bB(g)cC(g)+dD(g)计量关系a+b>c+da+bv′逆v正、v逆同时减小,v′逆>v′正v正、v逆同时增大,v′逆>v′正v正、v逆同时减小,v′正>v′逆平衡移动方向正向移动逆向移动逆向移动正向移动速率与时间的图象规律在其他条件不变的情况下,增大压强,平衡向气体物质的量减小的方向移动;减小压强,平衡向气体物质的量增大的方向移动微点拨:压强改变只影响有气体参加或生成的可逆反应,对于只涉及固体或液体的反应,压强的影响不予考虑。四、温度对化学平衡的影响1.实验探究温度对化学平衡的影响实验原理2NO2(g)N2O4(g)ΔH=-56.9kJ·mol-1红棕色无色实验步骤实验现象热水中混合气体颜色加深;冰水中混合气体颜色变浅实验结论混合气体受热颜色加深,说明NO2浓度增大,即平衡向逆反应方向移动;混合气体被冷却时颜色变浅,说明NO2浓度减小,即平衡向正反应方向移动2.从vt图像认识温度对化学平衡的影响化学平衡aA+bBcC+dDΔH>0温度改变升温降温速率变化v正、v逆同时增大,且v′正>v′逆v正、v逆同时减小,且v′逆>v′正移动方向正向移动逆向移动速率与时间的图像规律在其他条件不变的情况下,升高温度,平衡向吸热反应的方向移动;降低温度,平衡向放热反应的方向移动五、催化剂使用正催化剂,正、逆反应速率增大的倍数相同,化学平衡不移动。其图像如下:微点拨:若某可逆反应在反应前后气体的总体积不发生变化,则增大该体系的压强(压缩容器体积)时,也可用上述图像表示。催化剂对化学平衡有没有影响?工业生产往往使用催化剂,其目的是什么?提示:催化剂能够同等程度改变正、逆反应的速率,所以使用催化剂不能使平衡发生移动,但是可以改变达到平衡所需要的时间。工业生产往往使用催化剂,其目的是加快化学反应的速率,提高单位...