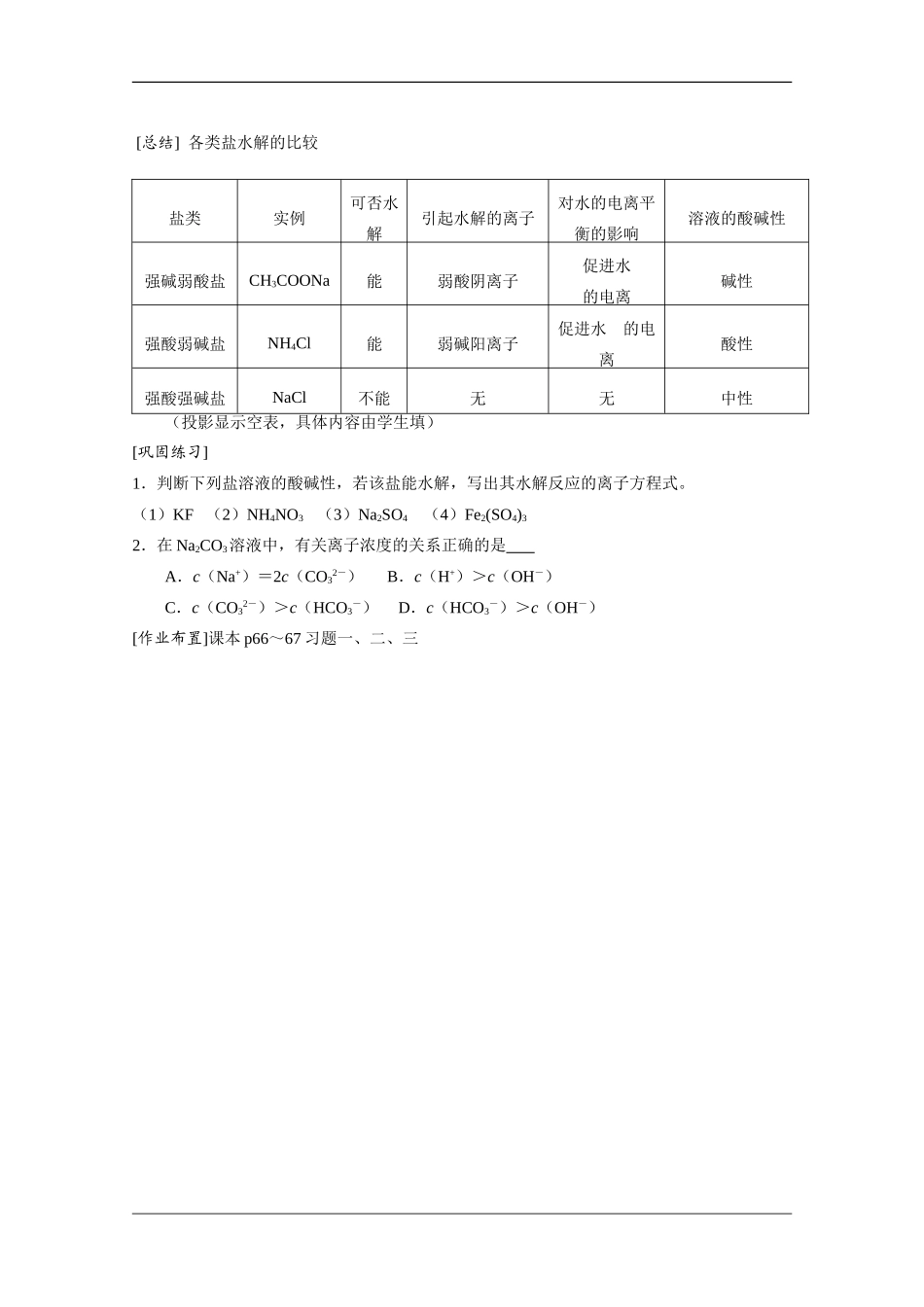
盐类的水解[教学目标]1.知识:使学生理解盐类水解的实质,掌握水解的规律,学会写盐类水解的离子方程式。2.能力:培养和发展学生的观察能力、思维能力、自学能力和实验能力。3.德育:培养学生辩证唯物主义观点,同时对学生进行科学态度和科学方法的训练。[教学重点]盐类水解的本质[教学难点]盐类水解方程式的书写和分析[教学用具]试管、玻璃棒、CH3COONa、Na2CO3、NH4Cl、Al2(SO4)3、NaCl、KNO3、蒸馏水、酚酞试液、pH试纸。[教学方法]启发、引导、探究[教学过程设计][提问引入]酸溶液显酸性,碱溶液显碱性,盐溶液是否都显中性?[演示]1.用酚酞试液检验Na2CO3溶液的酸碱性。2.用pH试纸检验NH4Cl、NaCl溶液的酸碱性。(通过示范说明操作要领,并强调注意事项)[学生实验]用pH试纸检验CH3COONa、Al2(SO4)3、KNO3溶液的酸碱性。[讨论]上述实验结果说明盐溶液的酸碱性与生成该盐的酸和碱的强弱间有什么关系。[学生小结]盐的组成与盐溶液酸碱性的关系:强碱弱酸盐(如:CH3COONa、Na2CO3)的水溶液显碱性强酸弱碱盐(如:Al2(SO4)3、NH4Cl)的水溶液显酸性强酸强碱盐(如:NaCl、KNO3)的水溶液显中性[过渡]下面我们分别研究不同类盐的水溶液酸碱性不同的原因。[板书]一、盐类的水解1.强碱弱酸盐的水解[讨论](1)CH3COONa溶液中存在着几种离子?(2)哪些离子可能相互结合,对水的电离平衡有何影响?(3)为什么CH3COONa溶液显碱性?[播放课件]电脑动画模拟CH3COONa的水解过程。[讲解]CH3COONa溶于水时,CH3COONa电离出的CH3COO-和水电离出的H+结合生成难电离的CH3COOH,消耗了溶液中的H+,使水的电离平衡向右移动,产生更多的OH-,使得建立新平衡时,溶液中c(OH-)>c(H+),从而显碱性。[板书](1)CH3COONa的水解CH3COONa+H2OCH3COOH+NaOH或CH3COO-+H2OCH3COOH+OH-[小结](投影)(1)溶液中盐电离产生的离子跟水所电离产生的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。(2)只有弱酸的酸根或弱碱的阳离子才能与H+或OH-结合生成弱电解质。(3)盐类水解使水的电离平衡发生了移动,并使溶液显酸性或碱性。(4)盐类水解反应是酸碱中和反应的逆反应。(5)盐类水解是可逆反应,反应方程式中要写“”号。[讨论]分析Na2CO3的水解过程,写出有关反应的离子方程式。[板书](2)Na2CO3的水解第一步:CO32-+H2OHCO3-+OH-(主要)第二步:HCO3-+H2OH2CO3+OH-(次要)[强调](1)多元弱酸的盐分步水解,以第一步为主。(2)一般盐类水解的程度很小,水解产物很少。通常不生成沉淀或气体,也不发生分解。在书写离子方程式时一般不标“↓”或“↑”,也不把生成物(如H2CO3、NH3·H2O等)写成其分解产物的形式。[板书]2.强酸弱碱盐的水解[讨论]应用盐类水解的原理,分析NH4Cl溶液显酸性的原因,并写出有关的离子方程式。[学生小结]NH4Cl溶于水时电离出的NH4+与水电离出的OH-结合成弱电解质NH3·H2O,消耗了溶液中的OH-,使水的电离平衡向右移动,产生更多的H+,使得建立新平衡时,溶液中c(H+)>c(OH-),从而显酸性。[讨论]以NaCl为例,说明强酸强碱盐能否水解。[学生小结]由于NaCl电离出的Na+和Cl-都不能与水电离出的OH-或H+结合生成弱电解质,所以强酸强碱盐不能水解,不会破坏水的电离平衡,因此其溶液显中性。[总结]各类盐水解的比较(投影显示空表,具体内容由学生填)[巩固练习]1.判断下列盐溶液的酸碱性,若该盐能水解,写出其水解反应的离子方程式。(1)KF(2)NH4NO3(3)Na2SO4(4)Fe2(SO4)32.在Na2CO3溶液中,有关离子浓度的关系正确的是A.c(Na+)=2c(CO32-)B.c(H+)>c(OH-)C.c(CO32-)>c(HCO3-)D.c(HCO3-)>c(OH-)[作业布置]课本p66~67习题一、二、三w.w.w.k.s.5.u.c.o.m盐类实例可否水解引起水解的离子对水的电离平衡的影响溶液的酸碱性强碱弱酸盐CH3COONa能弱酸阴离子促进水的电离碱性强酸弱碱盐NH4Cl能弱碱阳离子促进水的电离酸性强酸强碱盐NaCl不能无无中性