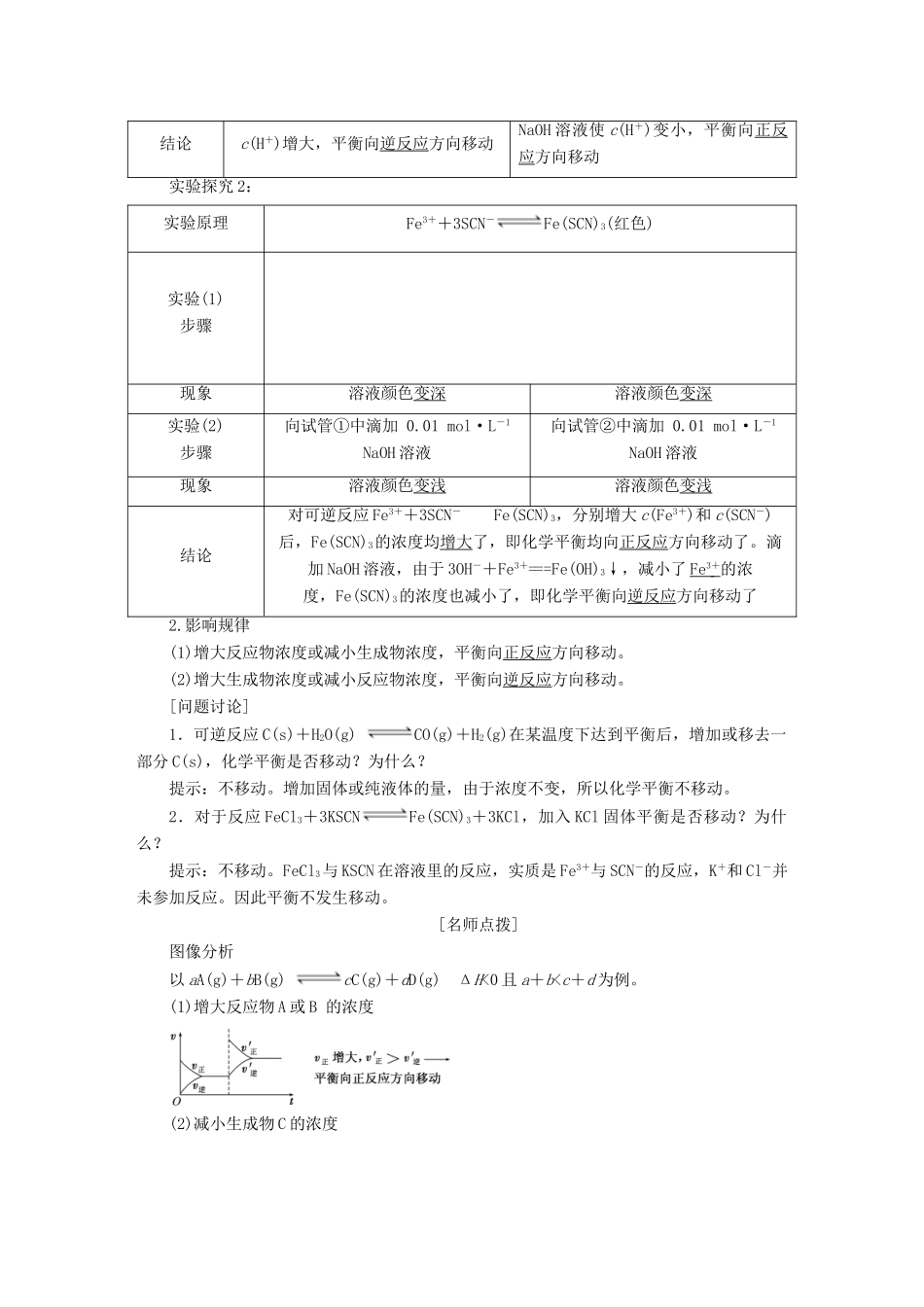
第2课时化学平衡的移动1.通过外界条件对可逆反应速率的影响,掌握化学平衡移动的内在因素。2.通过实验探究,掌握浓度、压强、温度影响化学平衡移动的规律。3.了解催化剂影响化学反应速率的实质,并进一步探讨对化学平衡的影响,从而了解催化剂在化工生产中的应用。4.认识化学反应速率、化学平衡典型图像,学会化学平衡图像题的分析解答方法。1.影响化学平衡状态的因素(1)浓度:增大反应物浓度,正反应速率明显加快,平衡向正反应方向移动;增大生成物浓度,逆反应速率明显加快,平衡向逆反应方向移动。(2)温度:升高温度,平衡向吸热方向移动,降低温度平衡向放热方向移动。(3)催化剂:催化剂能同等程度地增加正反应速率和逆反应速率,因此,催化剂对化学平衡的移动没有影响。2.化学平衡状态的移动化学反应体系的平衡状态可以通过改变反应条件(温度、浓度、气体反应的压强)而发生变化的现象,称作平衡状态的移动,简称平衡移动。3.勒夏特列原理如果改变影响平衡的条件之一(温度、压强、以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动。[新知探究]1.实验探究实验探究1:实验原理\s\up7(Cr2O\o\al(2-+H2O\s\up7(2CrO\o\al(2-+2H+实验步骤实验现象橙黄色变为橙色橙黄色变为黄色结论c(H+)增大,平衡向逆反应方向移动NaOH溶液使c(H+)变小,平衡向正反应方向移动实验探究2:实验原理Fe3++3SCN-Fe(SCN)3(红色)实验(1)步骤现象溶液颜色变深溶液颜色变深实验(2)步骤向试管①中滴加0.01mol·L-1NaOH溶液向试管②中滴加0.01mol·L-1NaOH溶液现象溶液颜色变浅溶液颜色变浅结论对可逆反应Fe3++3SCN-Fe(SCN)3,分别增大c(Fe3+)和c(SCN-)后,Fe(SCN)3的浓度均增大了,即化学平衡均向正反应方向移动了。滴加NaOH溶液,由于3OH-+Fe3+===Fe(OH)3↓,减小了Fe3+的浓度,Fe(SCN)3的浓度也减小了,即化学平衡向逆反应方向移动了2.影响规律(1)增大反应物浓度或减小生成物浓度,平衡向正反应方向移动。(2)增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动。[问题讨论]1.可逆反应C(s)+H2O(g)CO(g)+H2(g)在某温度下达到平衡后,增加或移去一部分C(s),化学平衡是否移动?为什么?提示:不移动。增加固体或纯液体的量,由于浓度不变,所以化学平衡不移动。2.对于反应FeCl3+3KSCNFe(SCN)3+3KCl,加入KCl固体平衡是否移动?为什么?提示:不移动。FeCl3与KSCN在溶液里的反应,实质是Fe3+与SCN-的反应,K+和Cl-并未参加反应。因此平衡不发生移动。[名师点拨]图像分析以aA(g)+bB(g)cC(g)+dD(g)ΔH<0且a+b