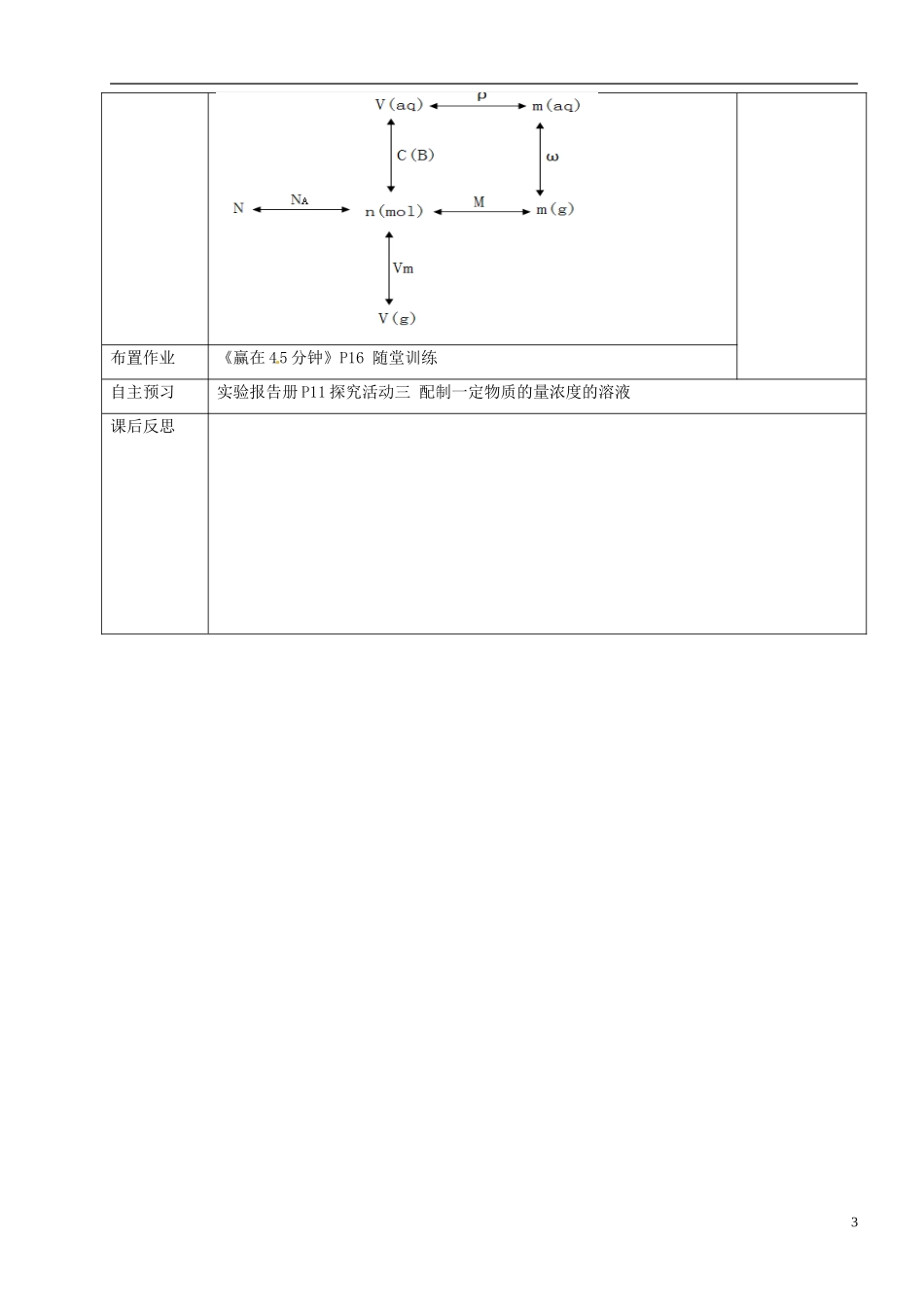
甘肃省永昌县第一中学高一化学教案第二节化学计量在实验中的应用(三)——物质的量在化学实验中的应用三维目标知识与技能1.知道物质的量浓度的概念,会运用其进行相关计算;2.知道物质的量浓度溶液中溶质的质量分数之间的联系,学会物质的量浓度与质量分数之间的相互换算;3.学会配置一定物质的量浓度溶液,掌握实验步骤以及误差分析原理。过程与方法1.引导学生学习“物质的量浓度”与“质量分数”,培养学生对比学习的能力;2.通过小组合作探究、讨论,进一步强化学习小组的功能;3.通过配制一定物质的量浓度溶液的实验操作,进一步强化实验室安全,并培养学生动手能力以及观察分析实验的能力。情感态度与价值观通过理论与实验的联系,让学生体会引入物质的量的必要性和重要性。学习重点物质的量浓度的概念、应用学习难点物质的量浓度的相关计算教学过程修改建议导入新课在化学实验中经常要用到溶液,为了操作方便,我们一般取用液体时并不是称其质量,而是量取它的体积。而在化学反应中,反应物与生成物之间的比例关系是由化学方程式中的化学计量数所决定的。如果可以知道一定体积的溶液中溶质的物质的量,对于计算化学反应中各物质之间量比关系是非常方便。展示目标1.理解记忆物质的量浓度的概念、意义、符号、单位;2.学会有关物质的量浓度的计算;3.知道溶质的物质的量浓度与溶质的质量分数之间的关系以及溶液稀释规律;4.学会配置一定物质的量浓度溶液的方法,记住实验步骤;5.建立物质的质量、体积、微粒数目以及溶质的物质的量浓度之间的关系,并学会相关计算。师导生学交流讨论【自主学习】阅读课本P15-17三、物质的量在化学实验中的应用完成《赢在45分钟》P14自主预习1【小组讨论】P16学与问1、2、3;《赢在45分钟》P15探究一、二达标检测1.判断下列说法是否正确?A.0.1mol/L的NaCl溶液表示的是1L溶剂中溶解了0.1molNaCl的溶液;B.从1L1mol/L的NaOH溶液中取出100ml,则n(NaOH)=0.1mol,C(NaOH)=0.1mol/L;C.0.1mol/L的CaCl2溶液中C(Cl-)也为0.1mol/L;D.将标准状况下德2.24LHCl通入水中配成1L溶液所得溶液中溶质的物质的量浓度为0.1mol/L;E.物质的量浓度与溶质的质量分数都是表示溶液组成的物理量。2.1L2mol/L的NaCl溶液中,C(NaCl)=;C(Cl-)=;n(Cl-)=;n(Na+)=。3.把5molMgCl2溶于水配成500ml溶液,所得溶液中C(MgCl2)=;C(Mg2+)=;C(Cl-)=。3.已知2LAl2(SO4)3溶液,Al3+的个数为9.03×1023个,则SO42-的物质的量浓度为。4.在一定温度下将300mL4mol/LNaCl溶液分为200mL(记为A)和100mL(记为B)两份,下列说法中正确的是:()a.A和B中NaCl的物质的量浓度相同;b.A中NaCl的物质的量浓度较大.c.A中NaCl的物质的量较小;d.B中NaCl的物质的量较小.e.A和B的密度相同;f.A中H2O的物质的量较大.疑难点拨1.物质的量浓度与溶质的质量分数的联系:区别:C(B)=n(B)/V(aq)ω(B)=m(B)/m(aq)×100%联系:C(B)=1000ρω/M(B)2.稀释定律:C(浓溶液)•V(浓溶液)=C(稀溶液)•V(稀溶液)课堂小结二、物质的量在化学实验中的应用1.物质的量浓度:C(B)=n(B)/V(aq)mol/L2.溶液配制:计算→称量→溶解→转移→洗涤→定容→摇匀主要仪器:托盘天平、烧杯、容量瓶、胶头滴管、玻璃棒等3.以物质的量为中心的相关计算:2布置作业《赢在45分钟》P16随堂训练自主预习实验报告册P11探究活动三配制一定物质的量浓度的溶液课后反思3