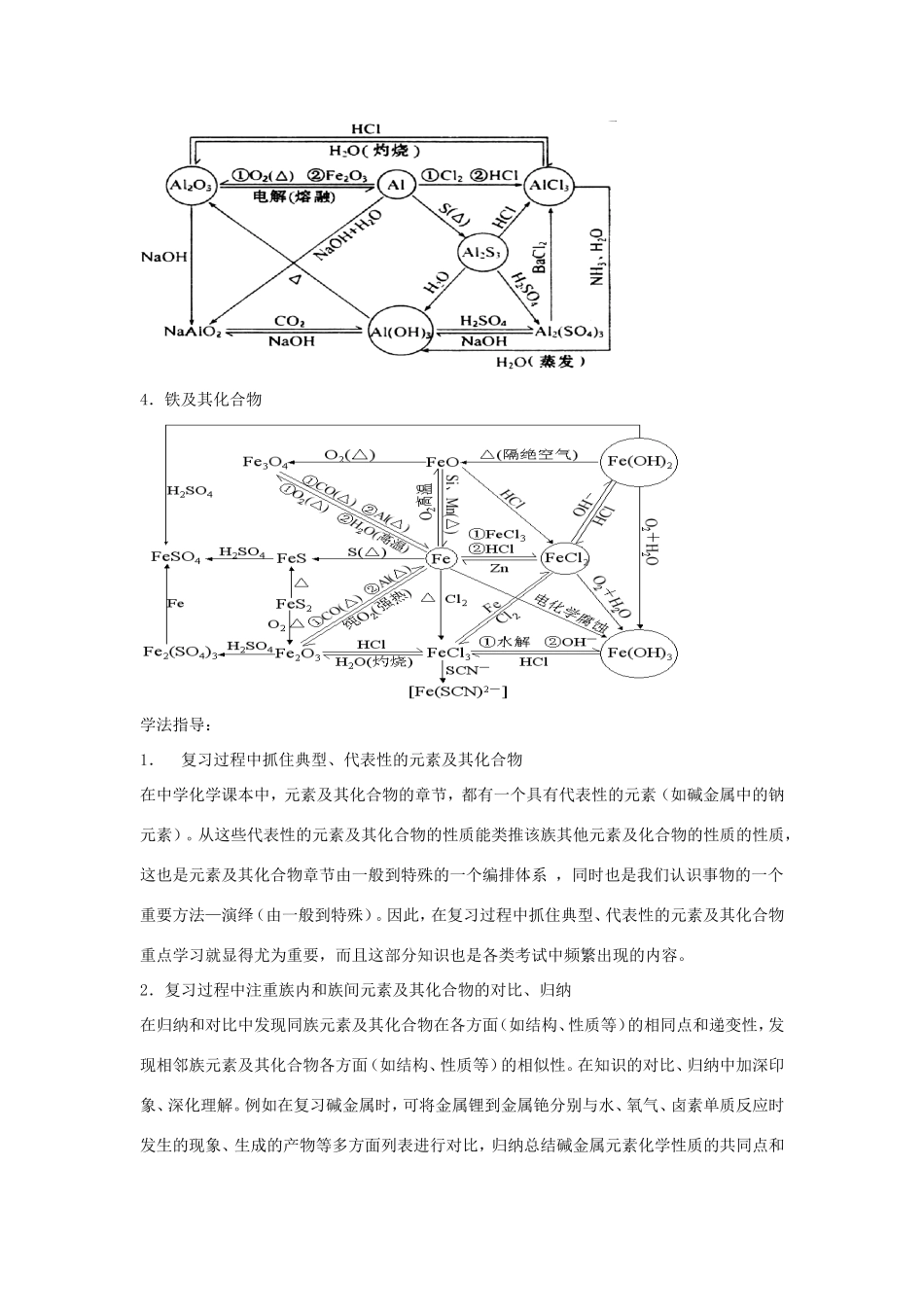
第二部分金属元素及其化合物考纲要求常见金属元素(如碱金属、铝、镁、铁和铜等)1.掌握常见金属元素单质及其重要化合物的主要性质,了解其应用。2.了解常见金属元素单质及其重要化合物对环境质量的影响。3.以上各部分知识的综合应用知识网络1.钠及其化合物2.镁及其他合物3.铝及其合物4.铁及其化合物学法指导:1.复习过程中抓住典型、代表性的元素及其化合物在中学化学课本中,元素及其化合物的章节,都有一个具有代表性的元素(如碱金属中的钠元素)。从这些代表性的元素及其化合物的性质能类推该族其他元素及化合物的性质的性质,这也是元素及其化合物章节由一般到特殊的一个编排体系,同时也是我们认识事物的一个重要方法—演绎(由一般到特殊)。因此,在复习过程中抓住典型、代表性的元素及其化合物重点学习就显得尤为重要,而且这部分知识也是各类考试中频繁出现的内容。2.复习过程中注重族内和族间元素及其化合物的对比、归纳在归纳和对比中发现同族元素及其化合物在各方面(如结构、性质等)的相同点和递变性,发现相邻族元素及其化合物各方面(如结构、性质等)的相似性。在知识的对比、归纳中加深印象、深化理解。例如在复习碱金属时,可将金属锂到金属铯分别与水、氧气、卤素单质反应时发生的现象、生成的产物等多方面列表进行对比,归纳总结碱金属元素化学性质的共同点和递变性。3.复习过程中重视化学实验,在各种不同类型的实验中去提高自己的能力对于课堂演示实验,要善于去观察实验现象,尝试用规范的化学用语描述实验现象、解释现象发生的原因;对于学生实验要勇于去参与,培养自己的实验操作能力。特别是对于一些探索性的开放型的实验,是对实验能力与理论知识的综合考查。在学习过程中体会化学实验对化学理论知识的巩固加深,化学理论知识是对化学实验的指导。第8讲碱金属元素★考情直播1、考纲解读考纲内容能力要求考向定位1.了解常见金属的活动顺序。2.了解常见金属及其重要化合物的主要性质,了解其应用。1.以钠为例,了解碱金属的物理性质和化学性质。理解碱金属元素性质的相似性和递变性。2.以氢氧化钠为例,了解重要的碱的性质和用途。了解钠的重要化合物(如碳酸钠和碳酸氢钠)。3.以Na2O2为例,了解碱金属元素是近几年高考的重点内容之一,涉及的内容有:1.钠、钾与水、盐溶液反应的现象及产物;2.Na2O2与CO2、H2O发生的反应;3.NaOH作为强碱,与很多物质发生复分解反应,此内容广泛出现在离子方程式、物质的鉴别、提纯和离子共存中;4.Na2CO3、NaHCO3性质的异同,以及互相转化、提纯,还有由它们组成的混合物的计算;5.焰色反应;过氧化物的性质。4.了解焰色反应,并能用焰色反应检验钠、钾等元素。6.同族元素性质的判断,其中尤以涉及Na2O2的题目更为常见。2、考点整合考点1钠与水反应及应用1.钠与水的反应可以概括为:五个字来记忆。(1)钠投入水中并浮在水面上——密度水。(2)钠立即跟水反应,并,发出嘶嘶声,产生气体。(3)同时钠熔成一个闪亮的小球并在水面上向各方向迅速游动最后消失——。(4)反应后的水溶液使酚酞——与水反应生成NaOH。2.钠与酸溶液反应当钠投入酸溶液中,钠首先与酸电离出的H+反应:;当酸完全反应后,过量的钠再与水反应,故钠与酸溶液反应比钠与水反应。3.钠与盐溶液的反应实质上是先与水反应生成NaOH,NaOH再与盐反应。与CuSO4溶液反应:2Na+2H2ONaOH+H2↑(1)CuSO4+2NaOHNa2SO4+Cu(OH)2(2)合并(1)(2)得:(2)与FeCl3溶液反应:[特别提醒]:钠和盐溶液反应,不能置换出盐中的金属,这是因为金属阳离子在水中一般是以水合离子形式存在,即金属离子周围有一定数目的水分子包围着,不能和钠直接接触。钠与熔融的盐反应才可能置换出盐中的金属。[例1]下列关于钠与水反应的说法不正确的是()①将小块钠投入滴有石蕊试液的水中,反应后溶液变红;②将钠投入稀盐酸中,钠先与水反应,后与盐酸反应;③钠在水蒸气中反应时因温度高会发生燃烧;④将两小块质量相等的金属钠,一块直接投入水中,另一块用锡箔包住,在锡箔上刺些小孔,然后按入水中,两者放出的氢气质量相等。A.①②B.②③C.②③...