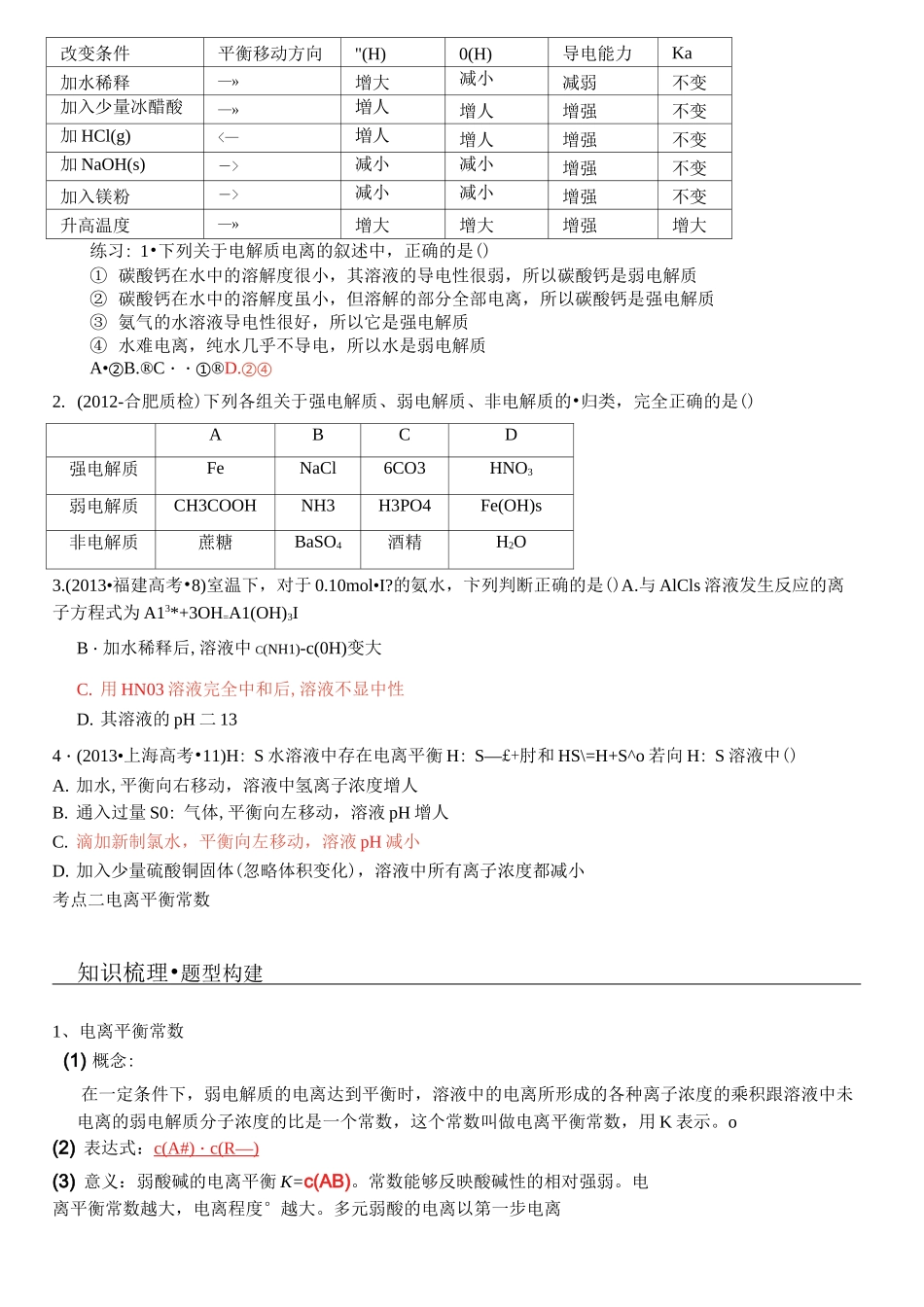
小结:髀(6种):HCkH2SO4、HNOjxHBr、HI、HC1O4强电强电解质完全电离,书写时用“=”号弱电解质部分电离,书时用“一”号强等注意:酸式盐电水溶液中的离子平衡考点一弱电解质的电离平衡1、电解质与非电解质(1)电解质:在水溶液中或熔融状态时能够导电的化合物(2)非电解质:在水溶液中和熔融状态都不能导电的化合物注意:(1)单质与混合物既不是电解质也不是非电解质(2)CO,NHs等溶于水得到的水溶液能导电,但它们不是电解质,因为导电不是其自身电离的离子。(3)强电解质不等于易溶于水的化合物(如BaS(\不溶于水,但溶于水的BaSO,全部电离,故BaSOi为强电解质)一一电解质的强弱与导电性、溶解性无关2.强电解质与弱电解质⑴概念(2)与化合物类型的关系强电解质主要是大部分离子化合物及少数共价化合物。弱电解质主要是共价化合物。(3)强弱电解质的区分依据不是看该物质溶解度的人小,也不是看其水溶液导电能力的强弱,而是看溶于水的部分是否完全电离。(1)电离平衡的建立在一定条件下(如温度、压强等),当弱电解质电离的速率和离子结合成分子的速率相等时,电离过程达到了平衡。(2)电离平衡的特征(3)外界条件对电离平衡的影响①内因:弱电解质本身的性质。②外因:a.温度:升高温度,电离平衡向电离方向移动,电离程度增人,原因是电离过程吸热。b.浓度:加水稀释,使弱电解质的浓度减小,电离平衡向电离的方向移动,电离程度增人。c.同离子效应:例如向CHsCOOH溶液中加入CHsCOONa固体,溶液中c(CH3COO")増人,CH3COOH的电离平衡向左(填“左”或石")移动,电离程度减小,c(H)减小,pH值增大。(4)电离过程是可逆过程,可直接用化学平•衡移动原理去分析电离平衡。以0.1mol-L-1CH3COOH溶液为例:CH3COOH^="CH3COO正向吸热)。实例(稀溶液)CH3COOH—H+CH3C00AH>0改变条件平衡移动方向"(H)0(H)导电能力Ka加水稀释—»增大减小减弱不变加入少量冰醋酸—»増人增人增强不变加HCl(g)<—増人增人增强不变加NaOH(s)―>减小减小增强不变加入镁粉―>减小减小增强不变升高温度—»增大增大增强增大练习:1•下列关于电解质电离的叙述中,正确的是()①碳酸钙在水中的溶解度很小,其溶液的导电性很弱,所以碳酸钙是弱电解质②碳酸钙在水中的溶解度虽小,但溶解的部分全部电离,所以碳酸钙是强电解质③氨气的水溶液导电性很好,所以它是强电解质④水难电离,纯水几乎不导电,所以水是弱电解质A•②B.®C・・①®D.②④2.(2012-合肥质检)下列各组关于强电解质、弱电解质、非电解质的•归类,完全正确的是()ABCD强电解质FeNaCl6CO3HNO3弱电解质CH3COOHNH3H3PO4Fe(OH)s非电解质蔗糖BaSO4酒精H2O3.(2013•福建高考•8)室温下,对于0.10mol•I?的氨水,卞列判断正确的是()A.与AlCls溶液发生反应的离子方程式为A13*+3OH=A1(OH)3IB・加水稀释后,溶液中C(NH1)-c(0H)变大C.用HN03溶液完全中和后,溶液不显中性D.其溶液的pH二134・(2013•上海高考•11)H:S水溶液中存在电离平衡H:S—£+肘和HS\=H+S^o若向H:S溶液中()A.加水,平衡向右移动,溶液中氢离子浓度增人B.通入过量S0:气体,平衡向左移动,溶液pH增人C.滴加新制氯水,平衡向左移动,溶液pH减小D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小考点二电离平衡常数知识梳理•题型构建1、电离平衡常数(1)概念:在一定条件下,弱电解质的电离达到平衡时,溶液中的电离所形成的各种离子浓度的乘积跟溶液中未电离的弱电解质分子浓度的比是一个常数,这个常数叫做电离平衡常数,用K表示。o(2)表达式:c(A#)・c(R—)(3)意义:弱酸碱的电离平衡K=c(AB)。常数能够反映酸碱性的相对强弱。电离平衡常数越大,电离程度°越大。多元弱酸的电离以第一步电离lx—元弱碱:C(NH3•比O)2/取pH=2盐酸和醋酸各100ml,充分反应,下列叙述正确的是A・醋酸与锌反应生成的氢气多B.盐酸和醋酸中生成的氢气一样C•醋D.盐为主,各级电离平衡常数的人小差距较人。a:—元弱酸:CH3COOH^^CH3C(X)_+H+«仝(化。。。)((H)C(CH3COOH)①电离平衡常数化是温度函数,温度不变K不变。②R值越人,该弱电解质较易电离,其对应的弱酸弱碱较强;厂值...