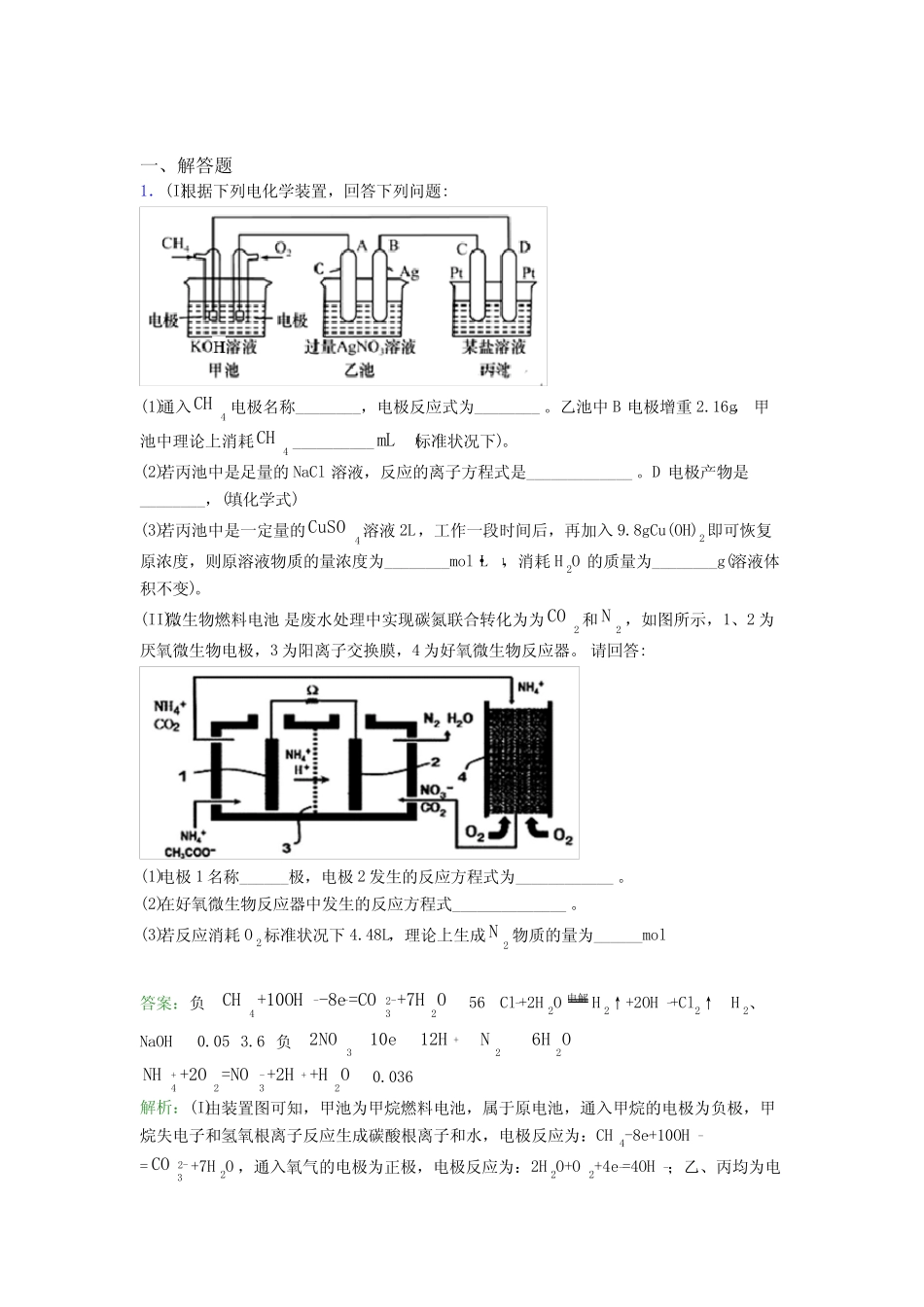
一、解答题1.(I)根据下列电化学装置,回答下列问题:(1)通入4CH电极名称________,电极反应式为________。乙池中B电极增重2.16g,甲池中理论上消耗4CH__________mL(标准状况下)。(2)若丙池中是足量的NaCl溶液,反应的离子方程式是_____________。D电极产物是________,(填化学式)(3)若丙池中是一定量的4CuSO溶液2L,工作一段时间后,再加入9.8gCu(OH)2即可恢复原浓度,则原溶液物质的量浓度为________mol·L−1,消耗H2O的质量为________g(溶液体积不变)。(II).微生物燃料电池是废水处理中实现碳氮联合转化为为2CO和2N,如图所示,1、2为厌氧微生物电极,3为阳离子交换膜,4为好氧微生物反应器。请回答:(1)电极1名称______极,电极2发生的反应方程式为____________。(2)在好氧微生物反应器中发生的反应方程式______________。(3)若反应消耗O2标准状况下4.48L,理论上生成2N物质的量为______mol答案:负--2-432CH+10OH-8e=CO+7HO56Cl-+2H2O电解H2↑+2OH-+Cl2↑H2、NaOH0.053.6负+3222NO10e12HN6HO+-+4232NH+2O=NO+2H+HO0.036解析:(I)由装置图可知,甲池为甲烷燃料电池,属于原电池,通入甲烷的电极为负极,甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应为:CH4-8e-+10OH-=2-3CO+7H2O,通入氧气的电极为正极,电极反应为:2H2O+O2+4e-=4OH-;乙、丙均为电解池,乙池中A与电源正极相连,则A为阳极,电极反应为:2H2O-4e-=4H++O2↑,B为阴极,电极反应为:Ag++e-=Ag,丙池中D与电源负极相连,D为阴极,C为阳极;(II)图示分析可知:酸性介质中,微生物燃料电池中氢离子移向2极,说明2原电池的正极,1原电池的负极,-3NO离子在正极得到电子生成氮气、发生还原反应,CH3COO-在原电池负极失电子、发生氧化反应生成二氧化碳气体,+4NH在好氧微生物反应器中转化为-3NO,据此分析解答。【详解】(I)(1)根据分析,通入4CH电极名称为负极,电极反应式为CH4-8e-+10OH-=2-3CO+7H2O;乙池中B电极电极反应为:Ag++e-=Ag,增重2.16g,即B电极上增加的Ag的物质的量为2.16g108g/mol=0.02mol,根据电极反应可知转移0.02mol电子,则甲池中理论上消耗n(CH4)=0.028mol,标况下的体积为0.028molx22.4L/mol=0.056L=56mL;(2)若丙池中是足量的NaCl溶液,为电解氯化钠溶液生成氯气、氢气和氢氧化钠,反应的离子方程式是Cl-+2H2O电解H2↑+2OH-+Cl2↑;D为阴极,电极反应为:2H2O+2e-=H2↑+2OH-,电极产物是H2、NaOH;(3)若丙池中是一定量的4CuSO溶液2L,阴极:2Cu2++4e-=2Cu阳极:2H2O-4e-=4H++O2↑,电池总反应为:2CuSO4+2H2O电解2Cu↓+O2↑+2H2SO4,离开反应体系的相当于是CuO,工作一段时间后,再加入9.8gCu(OH)2即可恢复原浓度,加入的Cu(OH)2的物质的量为9.8g98g/mol=0.1mol,Cu(OH)2相当于CuO·H2O,说明原溶液中0.1molCuSO4溶质电解完后,生成的H2SO4溶液发生了电解,即有0.1molH2O发生了电解,转移的电子总数为0.2mol,当转移0.2mol电子时,根据Cu2++2e-=Cu得知铜离子的物质的量为0.1mol,则原溶液CuSO4物质的量浓度为0.1mol2L=0.05mol·L−1,该电解过程中,铜离子全部电解时消耗了0.1molH2O,生成的硫酸继续电解时又消耗0.1molH2O,共消耗0.2molH2O,则整个电解过程中消耗H2O的质量为0.2mol×18g/mol=3.6g;(II)(1)根据分析,电极1名称负极,-3NO离子在正极得到电子生成氮气、发生还原反应,电极2发生的电极反应为--+3222NO+10e+12H=N+6HO;(2)在好氧微生物反应器中+4NH在好氧微生物反应器中转化为-3NO,结合电子守恒、电荷守恒,发生的反应方程式+-+4232NH+2O=NO+2H+HO;(3)电极1发生的电极反应为:CH3COO--8e-+2H2O=2CO2+7H+,电极2发生的电极反应为--+3222NO+10e+12H=N+6HO,好氧微生物反应器中反应方程式+-+4232NH+2O=NO+2H+HO,则整个转化总反应为:4CH3COONH4+11O2=8CO2+2N2↑+14H2O,若反应消耗O2标准状况下4.48L,即消耗4.48L22.4L/mol=0.2molO2,理论上生成2N物质的量为20.211mol≈0.036mol。【点睛】本题的易错点为(I)(3)中消耗水的质量计算,解答时易忽略,电解CuSO4过程中,电解产物H2SO4也发生了电解,电解两种物质的溶液时都会电解水,消耗水的总量为两...