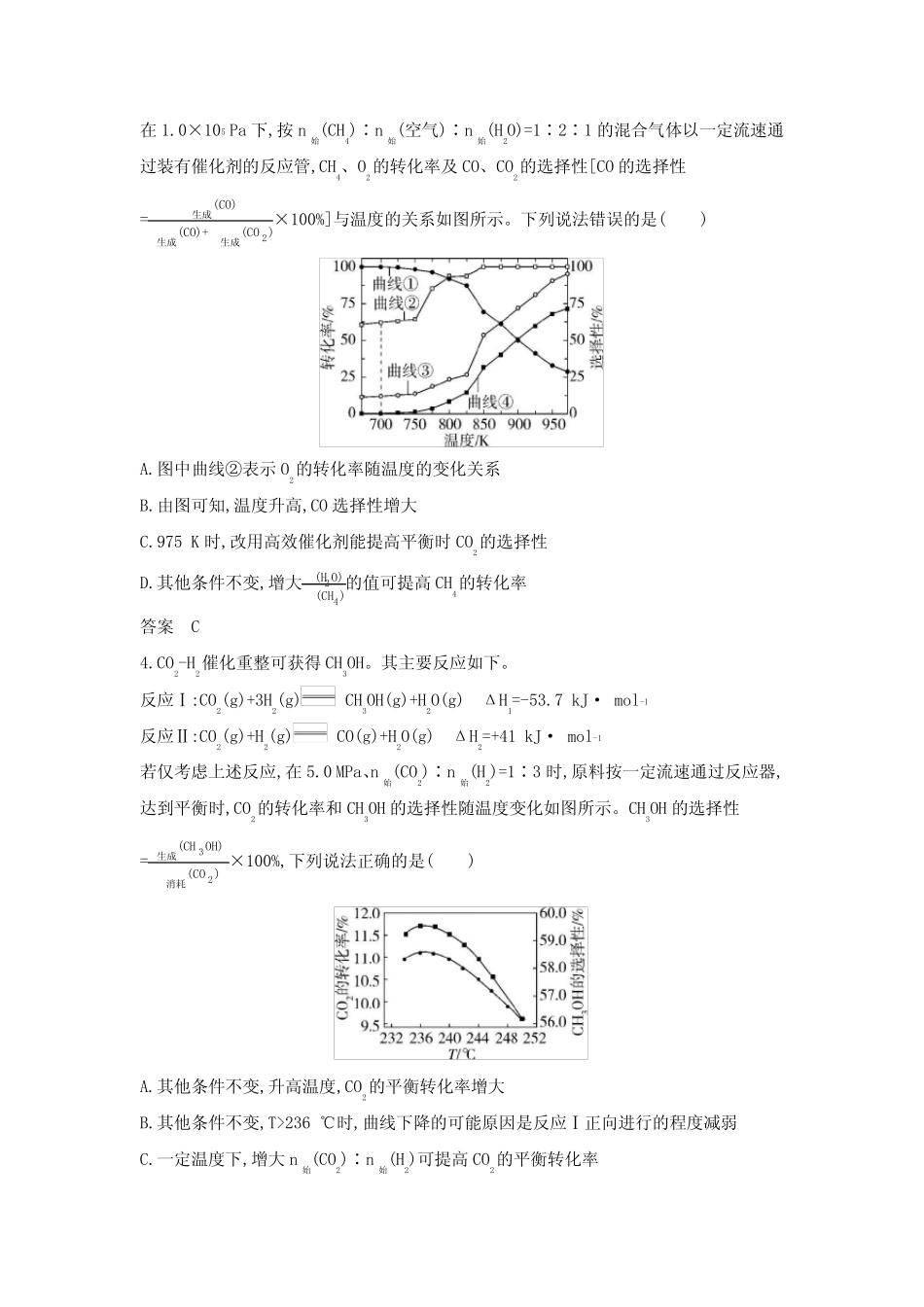
专题十一化学反应速率和化学平衡1.已知:(1)血红蛋白可与O2结合,血红蛋白更易与CO配位,血红蛋白与O2配位示意图如图所示。(2)血红蛋白(Hb)与O2、CO结合的反应可表示为①Hb+O2Hb(O2)K1;②Hb+COHb(CO)K2。下列说法不正确的是()A.相同温度下,K1>K2B.反应①、②的ΔH均小于0C.CO中的C原子提供孤电子对与Fe2+配位D.用高压氧舱治疗CO中毒时,平衡②逆向移动答案A2.反应2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)ΔH<0,可实现CO2的资源化利用,下列说法正确的是()A.上述反应在任何温度下均可自发进行B.上述反应每消耗1molCO2同时形成7molσ键C.上述反应平衡常数K=ᵅ(CH3OCH3)ᵅ2(CO2)·ᵅ6(H2)D.催化剂可以降低上述反应的焓变,加快化学反应速率答案B3.甲烷—湿空气自热重整制H2过程中零耗能是该方法的一个重要优点,原理如下:反应ⅠCH4(g)+32O2(g)CO(g)+2H2O(g)ΔH=-519kJ·mol-1反应ⅡCH4(g)+H2O(g)CO(g)+3H2(g)ΔH=206kJ·mol-1反应ⅢCO(g)+H2O(g)CO2(g)+H2(g)ΔH=-41kJ·mol-1在1.0×105Pa下,按n始(CH4)∶n始(空气)∶n始(H2O)=1∶2∶1的混合气体以一定流速通过装有催化剂的反应管,CH4、O2的转化率及CO、CO2的选择性[CO的选择性=ᵅ生成(CO)ᵅ生成(CO)+ᵅ生成(CO2)×100%]与温度的关系如图所示。下列说法错误的是()A.图中曲线②表示O2的转化率随温度的变化关系B.由图可知,温度升高,CO选择性增大C.975K时,改用高效催化剂能提高平衡时CO2的选择性D.其他条件不变,增大ᵅ(H2O)ᵅ(CH4)的值可提高CH4的转化率答案C4.CO2-H2催化重整可获得CH3OH。其主要反应如下。反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g)ΔH2=+41kJ·mol-1若仅考虑上述反应,在5.0MPa、n始(CO2)∶n始(H2)=1∶3时,原料按一定流速通过反应器,达到平衡时,CO2的转化率和CH3OH的选择性随温度变化如图所示。CH3OH的选择性=ᵅ生成(CH3OH)ᵅ消耗(CO2)×100%,下列说法正确的是()A.其他条件不变,升高温度,CO2的平衡转化率增大B.其他条件不变,T>236℃时,曲线下降的可能原因是反应Ⅰ正向进行的程度减弱C.一定温度下,增大n始(CO2)∶n始(H2)可提高CO2的平衡转化率D.研发高温高效催化剂可提高平衡时CH3OH的选择性答案B5.在恒温恒容的密闭容器中发生反应2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)ΔH<0,T℃时平衡常数为K,下列说法正确的是()A.该反应在任何温度下都可自发进行B.T℃时,若ᵅ(H2O)ᵅ(CO2)·ᵅ2(NH3)8后,总反应的速率常数k基本不变答案A8.将4molA和2molB在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g)。若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法,其中错误的是()①用物质A表示的反应的平均速率为0.6mol·L-1·s-1②反应速率分别表示为v(A)、v(B)、v(C),则2v(A)=v(B)③2s时物质A的转化率为30%④2s时物质B的浓度为0.7mol·L-1A.①②B.①③C.②③D.③④答案A9.一定温度下,在2L的恒容密闭容器中,“甲烷重整”反应(CH4+H2OCO+3H2)的原理如下。已知“甲烷重整”反应在不同温度下的化学平衡常数如下表所示:温度/℃850100012001400K0.522751772下列说法不正确的是()A.物质a可能是Fe3O4B.若增大n(CH4)∶n(H2O)的值,则CH4的平衡转化率降低C.CH...