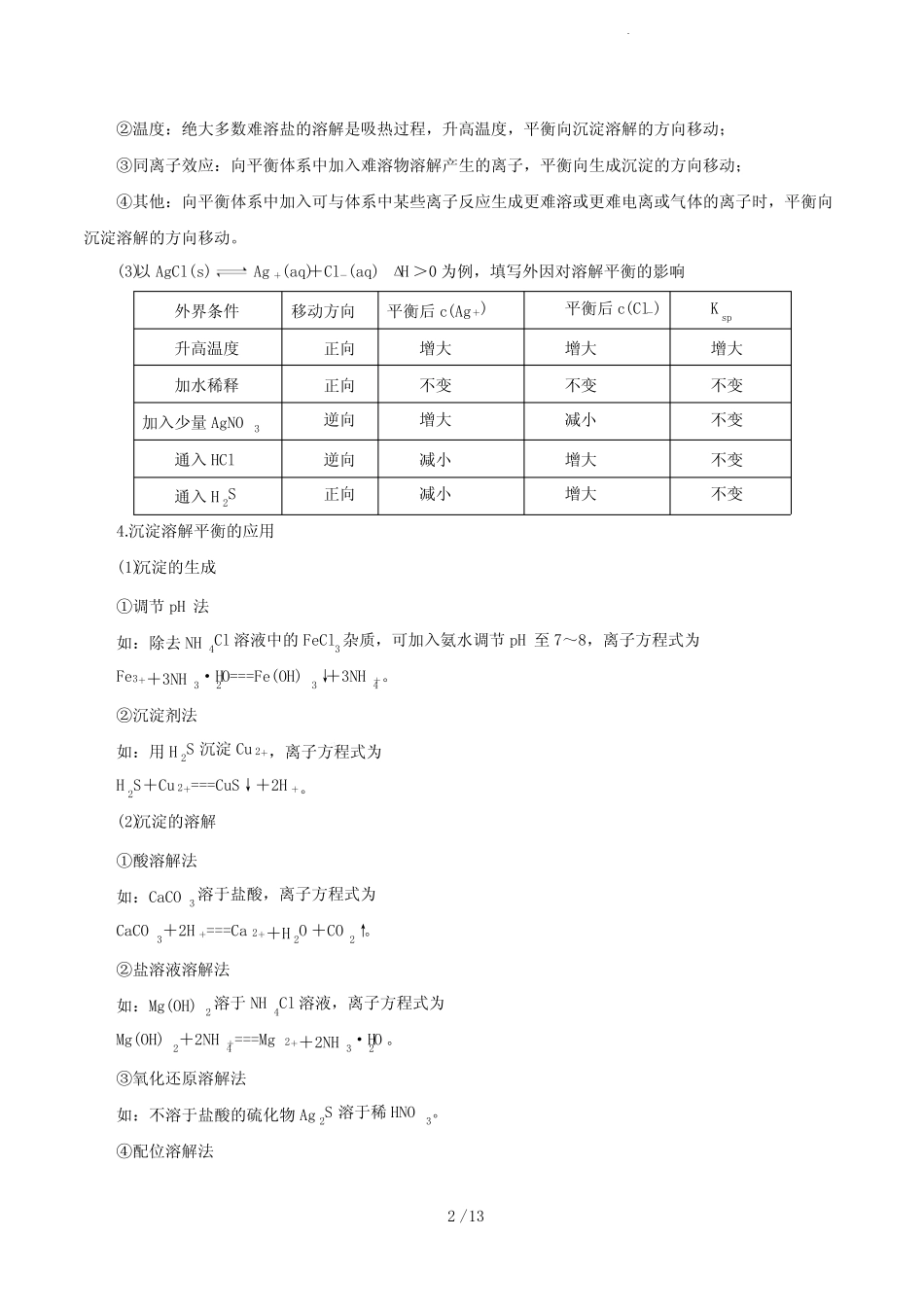
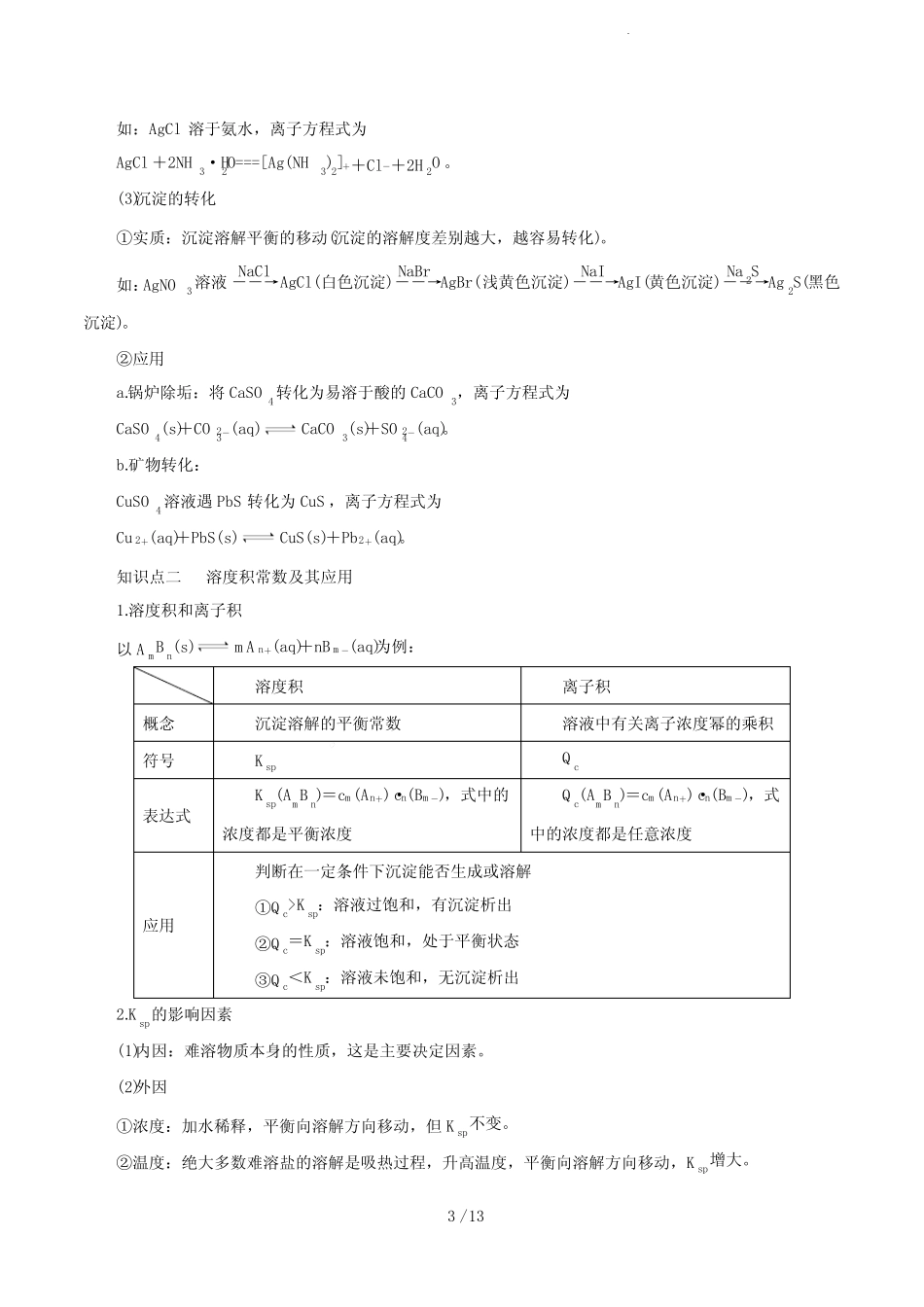
1/13第24讲沉淀溶解平衡1.了解难溶电解质的沉淀溶解平衡。2.理解溶度积(Ksp)的含义,能进行相关的计算。【核心素养分析】1.变化观念与平衡思想:认识难溶电解质的溶解有一定限度,是可以调控的。能多角度、动态地分析难溶电解质的沉淀溶解平衡,并运用难溶电解质的沉淀溶解平衡原理解决实际问题(如利用生成沉淀处理污水等)。2.科学研究与创新意识:能发现和提出有关难溶电解质的沉淀溶解平衡的判断问题;能从问题和假设出发,确定探究目的,设计探究方案,进行沉淀转化等实验探究。知识点一沉淀溶解平衡及应用1.难溶、可溶、易溶界定:20℃时,电解质在水中的溶解度与溶解性存在如下关系:2.沉淀溶解平衡(1)溶解平衡的建立溶质溶解的过程是一个可逆过程:固体溶质溶解结晶溶液中的溶质v溶解>v结晶固体溶解v溶解=v结晶溶解平衡v溶解<v结晶析出晶体(2)特点(同其他化学平衡):逆、等、定、动、变(适用平衡移动原理)3.影响沉淀溶解平衡的因素(1)内因难溶电解质本身的性质,这是决定因素。(2)外因①浓度:加水稀释,平衡向沉淀溶解的方向移动;2/13②温度:绝大多数难溶盐的溶解是吸热过程,升高温度,平衡向沉淀溶解的方向移动;③同离子效应:向平衡体系中加入难溶物溶解产生的离子,平衡向生成沉淀的方向移动;④其他:向平衡体系中加入可与体系中某些离子反应生成更难溶或更难电离或气体的离子时,平衡向沉淀溶解的方向移动。(3)以AgCl(s)Ag+(aq)+Cl-(aq)ΔH>0为例,填写外因对溶解平衡的影响外界条件移动方向平衡后c(Ag+)平衡后c(Cl-)Ksp升高温度正向增大增大增大加水稀释正向不变不变不变加入少量AgNO3逆向增大减小不变通入HCl逆向减小增大不变通入H2S正向减小增大不变4.沉淀溶解平衡的应用(1)沉淀的生成①调节pH法如:除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至7~8,离子方程式为Fe3++3NH3·H2O===Fe(OH)3↓+3NH+4。②沉淀剂法如:用H2S沉淀Cu2+,离子方程式为H2S+Cu2+===CuS↓+2H+。(2)沉淀的溶解①酸溶解法如:CaCO3溶于盐酸,离子方程式为CaCO3+2H+===Ca2++H2O+CO2↑。②盐溶液溶解法如:Mg(OH)2溶于NH4Cl溶液,离子方程式为Mg(OH)2+2NH+4===Mg2++2NH3·H2O。③氧化还原溶解法如:不溶于盐酸的硫化物Ag2S溶于稀HNO3。④配位溶解法3/13如:AgCl溶于氨水,离子方程式为AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O。(3)沉淀的转化①实质:沉淀溶解平衡的移动(沉淀的溶解度差别越大,越容易转化)。如:AgNO3溶液――→NaClAgCl(白色沉淀)――→NaBrAgBr(浅黄色沉淀)――→NaIAgI(黄色沉淀)――→Na2SAg2S(黑色沉淀)。②应用a.锅炉除垢:将CaSO4转化为易溶于酸的CaCO3,离子方程式为CaSO4(s)+CO2-3(aq)CaCO3(s)+SO2-4(aq)。b.矿物转化:CuSO4溶液遇PbS转化为CuS,离子方程式为Cu2+(aq)+PbS(s)CuS(s)+Pb2+(aq)。知识点二溶度积常数及其应用1.溶度积和离子积以AmBn(s)mAn+(aq)+nBm-(aq)为例:溶度积离子积概念沉淀溶解的平衡常数溶液中有关离子浓度幂的乘积符号KspQc表达式Ksp(AmBn)=cm(An+)·cn(Bm-),式中的浓度都是平衡浓度Qc(AmBn)=cm(An+)·cn(Bm-),式中的浓度都是任意浓度应用判断在一定条件下沉淀能否生成或溶解①Qc>Ksp:溶液过饱和,有沉淀析出②Qc=Ksp:溶液饱和,处于平衡状态③Qc<Ksp:溶液未饱和,无沉淀析出2.Ksp的影响因素(1)内因:难溶物质本身的性质,这是主要决定因素。(2)外因①浓度:加水稀释,平衡向溶解方向移动,但Ksp不变。②温度:绝大多数难溶盐的溶解是吸热过程,升高温度,平衡向溶解方向移动,Ksp增大。4/13③其他:向平衡体系中加入可与体系中某些离子反应生成更难溶物质或更难电离物质或气体的离子时,平衡向溶解方向移动,但Ksp不变。高频考点一影响沉淀溶解平衡的因素【例1】已知溶液中存在平衡:Ca(OH)2(s)Ca2+(aq)+2OH-(aq)ΔH<0,下列有关该平衡体系的说法正确的是()①升高温度,平衡逆向移动②向溶液中加入少量碳酸钠粉末能增大钙离子的浓度③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液④恒温下,向溶液中加入CaO,溶液的pH升高⑤给溶液加热,溶液的pH...