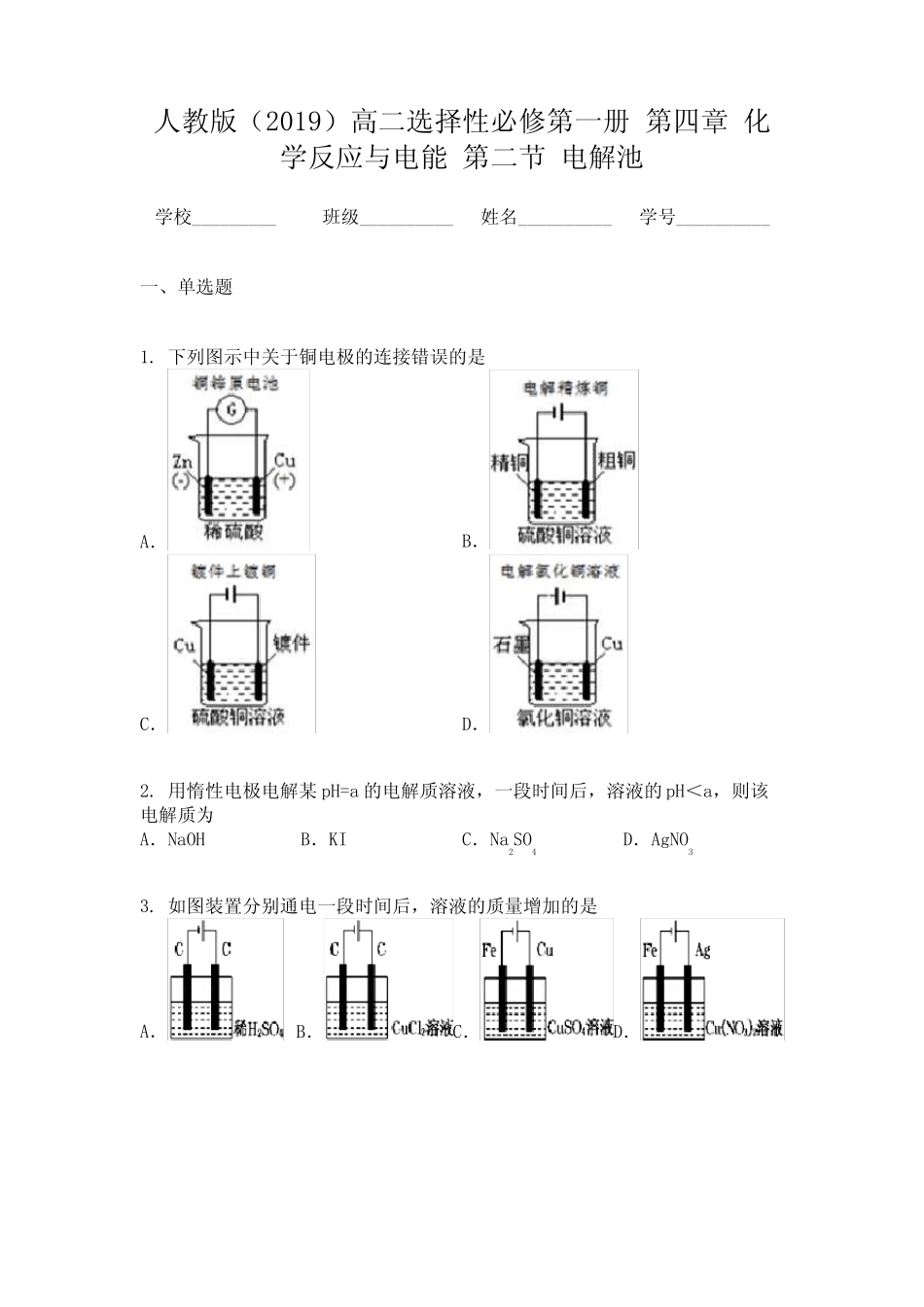
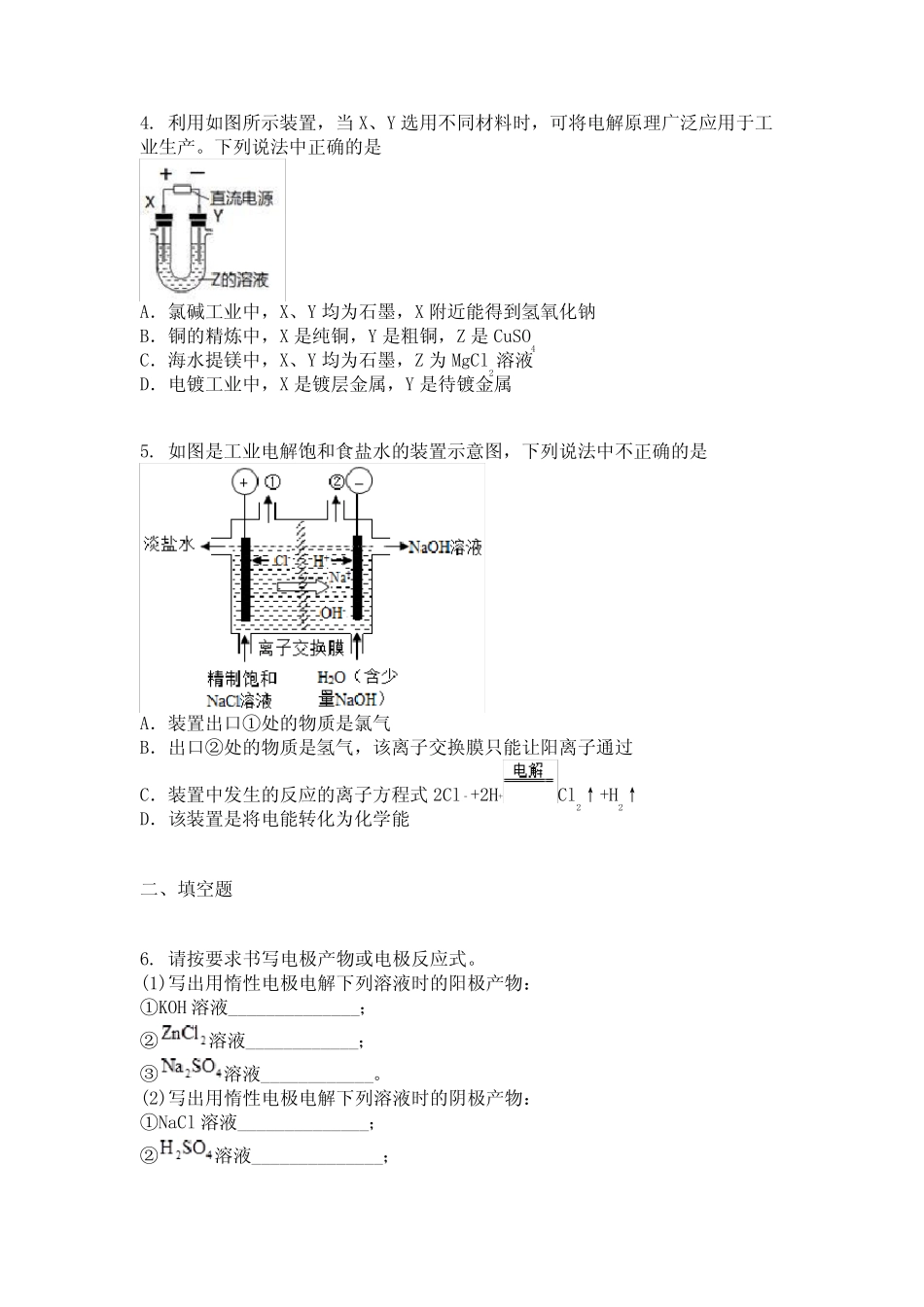
人教版(2019)高二选择性必修第一册第四章化学反应与电能第二节电解池学校_________班级__________姓名__________学号__________一、单选题1.下列图示中关于铜电极的连接错误的是A.B.C.D.2.用惰性电极电解某pH=a的电解质溶液,一段时间后,溶液的pH<a,则该电解质为A.NaOHB.KIC.Na2SO4D.AgNO33.如图装置分别通电一段时间后,溶液的质量增加的是A.B.C.D.4.利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是A.氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4C.海水提镁中,X、Y均为石墨,Z为MgCl2溶液D.电镀工业中,X是镀层金属,Y是待镀金属5.如图是工业电解饱和食盐水的装置示意图,下列说法中不正确的是A.装置出口①处的物质是氯气B.出口②处的物质是氢气,该离子交换膜只能让阳离子通过C.装置中发生的反应的离子方程式2Cl﹣+2H+Cl2↑+H2↑D.该装置是将电能转化为化学能二、填空题6.请按要求书写电极产物或电极反应式。(1)写出用惰性电极电解下列溶液时的阳极产物:①KOH溶液______________;②溶液____________;③溶液____________。(2)写出用惰性电极电解下列溶液时的阴极产物:①NaCl溶液______________;②溶液______________;③溶液_______________。(3)写出用Cu电极电解溶液的电极反应:阴极_______________;阳极_______________;总反应_____________。7.25℃时,用石墨电极电解2.0L溶液。5min后,在一个石墨电极上有6.4gCu生成。试回答下列问题:(1)发生氧化反应的是_____极,电极反应为__________。(2)若电解后溶液的体积不变,则电解后溶液的pH为___________。(3)若将溶液恢复到与电解前一样,则需加入______mol的__________。(4)若用等质量的两块铜片代替石墨作电极,当析出6.4gCu时,两铜片的质量相差_______g,电解液的pH_______(填“变小”“变大”或“不变”)。三、单选题8.如图甲为将电极置于含有和均为的电解液中(阴离子为),乙是甲装置电解过程中转移电子数与阴极的质量的变化关系图。下列说法错误的是A.过程Ⅰ中阴极上有金属银析出B.过程Ⅰ、Ⅱ、Ⅲ中溶液的均降低C.过程Ⅱ中阳极上有氧气放出D.过程Ⅱ析出的固体质量是过程Ⅰ的2倍四、多选题9.如图所示的电化学装置可实现苯转化为环己烷。下列有关叙述正确的是A.多孔惰性电极N接电源正极B.该装置工作时,质子从甲室移向乙室C.阴极电极反应为D.阴极导出的气体增重,则阳极生成(标准状况)气体五、单选题10.美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:下列说正确的是A.图中能量转化方式只有2种B.H+向a极区移动C.b极发生的电极反应为:N2+6H++6e-=2NH3D.a极上每产生22.4LO2流过电极的电子数一定为4×6.02×1023六、多选题11.过氧化氢是一种日常生活中常用的消毒剂,也是工业生产中的绿色氧化剂。以空气为原料,通过如图所示装置可制备过氧化氢。该装置工作时,下列判断正确的是A.b为电源负极,阴极电极反应为B.该装置的总反应为C.阳离子交换膜两侧电解液均增大D.该工艺中溶液可循环利用七、单选题12.工业上,常用溶液作腐蚀液,腐蚀铜电路板得到废液的主要成分是和含少量。某小组设计从废液中提取铜的装置如图所示:已知:失电子能力比强。下列说法正确的是A.电解初期,阴极没有铜析出,原因是B.石墨极的电极反应式为C.若将废液2充入阳极室时可再生腐蚀液(硫酸铁溶液)D.若电路中转移2mol电子,理论上有2molM从阴离子交换膜左侧向右侧迁移八、原理综合题13.粗锡的主要成分是锡,还含有锌、硫化亚铜、银、金杂质。下图1所示是工业提纯粗锡的一种方法,其电解装置如下图2所示:(1)流程图中的硅氟酸是一种强酸,有腐蚀性,能与反应。在该粗锡精制的工艺中,硅氟酸的作用是______,电解粗锡可选取的仪器有_______(填字母)。a.玻璃容器b.石英容器c.塑料容器d.蜡制容器(2)粗锡为电极_______(填“a”或“b”),该电极为_______(填“阳极”或“阴极”),电极反应式为_______。(3)阳极泥中含有的物质为________(写化学式)。(4)若电解时采用溶液作为电解液,...