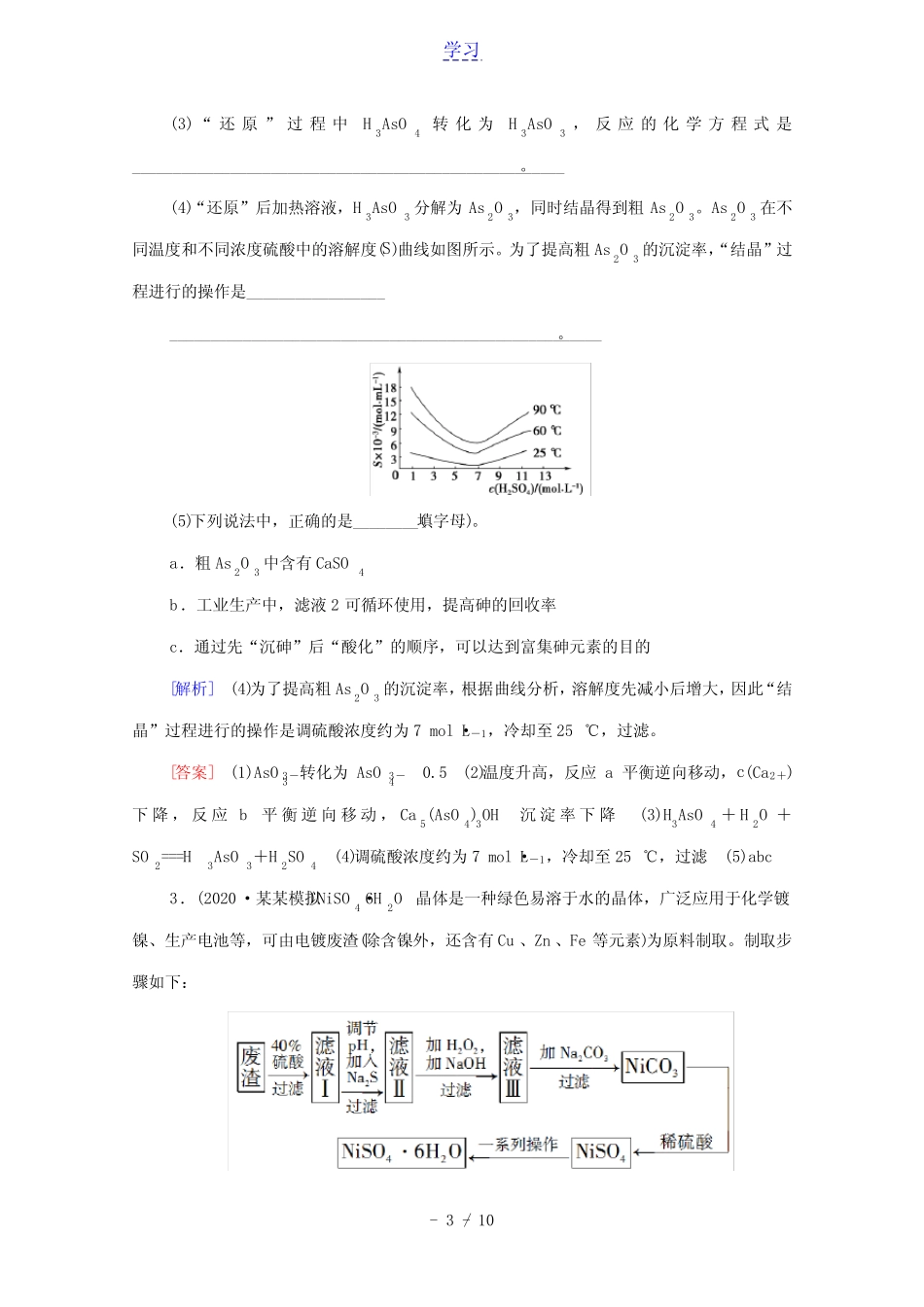
学习-1-/10化学工艺流程试题的突破方略(建议用时:40分钟)1.一种以NH4Cl酸性蚀铜废液[含NH4Cl、Cu(NH3)4Cl2、CuCl、CuSO4及盐酸等]为原料制备CuCl并回收Cu(OH)2的工艺流程如图:回答下列问题:(1)“反应1”中,NaCl、Cu与CuSO4反应的离子方程式为_____________________________________________________;生产中常将“过滤1”的滤渣返回到“反应1”中,其目的是_____________________________________________________。(2)“水解”步骤中,加入大量水稀释即可析出CuCl,原因是_______________________________________________________(结合离子方程式,从平衡角度分析)。(3)湿的CuCl在空气中易被氧化为Cu2(OH)3Cl,该反应的化学方程式为________________________________________________________________;“洗涤”时用稀盐酸和乙醇洗涤的目的是_____________________________________________________________________________________。(4)“反应2”需加入的试剂X是______________;“吹脱”出来的NH3可用于生产碳铵化肥,主要反应的化学方程式为_____________________________________________________。(5)测定产品中CuCl质量分数的步骤如下:称取ag产品,加入稍过量的FeCl3溶液,待溶解后用邻菲罗啉作指示剂,立刻用cmol·L-1的Ce(SO4)2标准溶液滴定到终点,消耗标学习-2-/10准溶液VmL。则产品中CuCl的质量分数为________(已知滴定反应为Ce4++Fe2+===Ce3++Fe3+,列出计算式)。[解析](5)根据电子守恒可得关系式:CuCl~Fe2+~Ce4+n(CuCl)=n(Ce4+)=V×10-3×cmolCuCl的质量分数为V×10-3×c×99.5a×100%[答案](1)Cu+Cu2++8Cl-===2CuCl3-4提高铜元素的利用率(2)CuCl3-4CuCl+3Cl-,稀释时,平衡向粒子数增多的方向移动,即平衡右移(3)4CuCl+O2+4H2O===2Cu2(OH)3Cl+2HCl[或12CuCl+3O2+6H2O===4Cu2(OH)3Cl+4CuCl2]盐酸抑制其水解和氧化,用乙醇洗涤可促使其快速干燥(或其他合理答案)(4)NaOH溶液(或其他合理答案)NH3+H2O+CO2===NH4HCO3(5)cV×10-3×99.5a×100%2.(2021·某某模拟)As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如下流程图转化为粗As2O3。(1)“氧化”的目的是________________________________,1molAsO3-3转化为AsO3-4至少需要O2________mol。(2)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:a.Ca(OH)2(s)Ca2+(aq)+2OH-(aq)ΔH<0b.5Ca2++OH-+3AsO3-4Ca5(AsO4)3OHΔH>0研究表明,“沉砷”的最佳温度是85℃。用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是_________________________________________________________________________________________。学习-3-/10(3)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_____________________________________________________。(4)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是______________________________________________________________________。(5)下列说法中,正确的是________(填字母)。a.粗As2O3中含有CaSO4b.工业生产中,滤液2可循环使用,提高砷的回收率c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的[解析](4)为了提高粗As2O3的沉淀率,根据曲线分析,溶解度先减小后增大,因此“结晶”过程进行的操作是调硫酸浓度约为7mol·L-1,冷却至25℃,过滤。[答案](1)AsO3-3转化为AsO3-40.5(2)温度升高,反应a平衡逆向移动,c(Ca2+)下降,反应b平衡逆向移动,Ca5(AsO4)3OH沉淀率下降(3)H3AsO4+H2O+SO2===H3AsO3+H2SO4(4)调硫酸浓度约为7mol·L-1,冷却至25℃,过滤(5)abc3.(2020·某某模拟)NiSO4·6H2O晶体是一种绿色易溶于水的晶体,广泛应用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe等元素)为原料制取。制取步骤如下:学习-4-/10(1)在实验室中,欲用98%的浓硫酸(密度1.84g·mL-1)配制40%的稀硫酸,需要的玻...