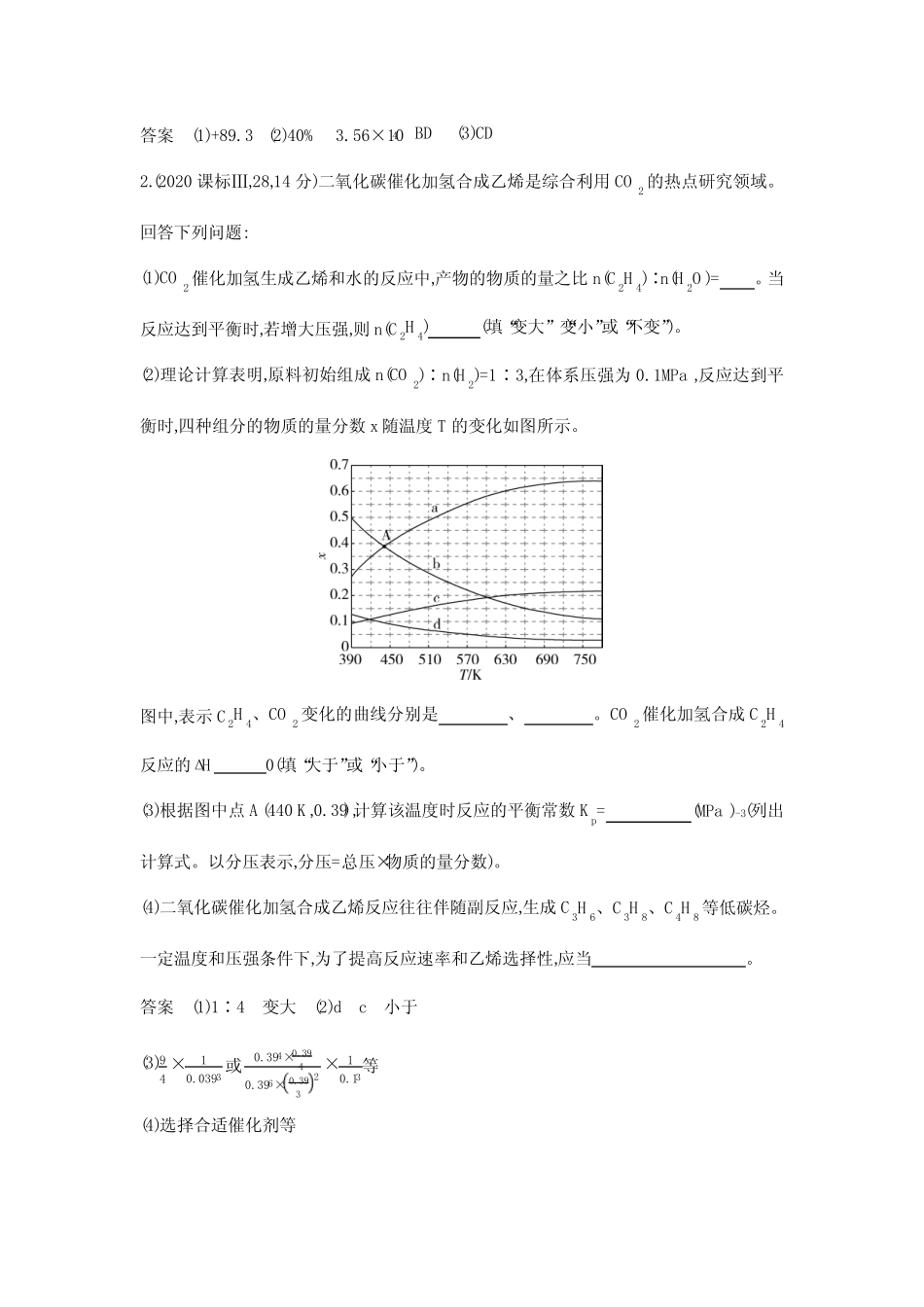
专题十一化学反应速率和化学平衡综合篇综合分压平衡常数(Kp)的计算1.(2019课标Ⅱ,27节选)环戊二烯()是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:(1)已知:(g)(g)+H2(g)ΔH1=100.3kJ·mol-1①H2(g)+I2(g)2HI(g)ΔH2=-11.0kJ·mol-1②对于反应:(g)+I2(g)(g)+2HI(g)③ΔH3=kJ·mol-1。(2)某温度下,等物质的量的碘和环戊烯()在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为,该反应的平衡常数Kp=Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有(填标号)。A.通入惰性气体B.提高温度C.增加环戊烯浓度D.增加碘浓度(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是(填标号)。A.T1>T2B.a点的反应速率小于c点的反应速率C.a点的正反应速率大于b点的逆反应速率D.b点时二聚体的浓度为0.45mol·L-1答案(1)+89.3(2)40%3.56×104BD(3)CD2.(2020课标Ⅲ,28,14分)二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶n(H2O)=。当反应达到平衡时,若增大压强,则n(C2H4)(填“变大”“变小”或“不变”)。(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。图中,表示C2H4、CO2变化的曲线分别是、。CO2催化加氢合成C2H4反应的ΔH0(填“大于”或“小于”)。(3)根据图中点A(440K,0.39),计算该温度时反应的平衡常数Kp=(MPa)-3(列出计算式。以分压表示,分压=总压×物质的量分数)。(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当。答案(1)1∶4变大(2)dc小于(3)94×10.0393或0.394×0.3940.396×0.3932×10.13等(4)选择合适催化剂等3.(2023届重庆巴蜀中学月考三,17)煤制甲醇工艺是煤高效利用的途径之一,生产工艺如图所示:(1)“煤气化”涉及反应:C(s)+H2O(g)CO(g)+H2(g)ΔH=+135kJ·mol-1。气化剂为H2O(g)和O2(g),关于“煤气化”的说法正确的是(填序号)。A.适量的氧气浓度有利于水煤气的生成B.适当降低水氧比有利于提高碳的转化率C.氧气的百分含量越高,对煤气化反应越有利D.煤气化反应会产生灰分和未反应的碳,故煤气化反应过程不适合使用催化剂(2)甲醇合成过程中涉及的主要反应如下:反应Ⅰ:CO(g)+2H2(g)CH3OH(g)ΔH1=-90.94kJ·mol-1反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH2=-49.47kJ·mol-1反应Ⅲ:CO(g)+H2O(g)CO2(g)+H2(g)ΔH3①反应Ⅰ在(填“高温”或“低温”)下能自发进行。②ΔH3=kJ·mol-1。③若要大幅度提高单位时间内反应Ⅱ的选择性,可采取的最佳措施是。④反应Ⅲ中,调控反应条件,CO和·OH(羟基自由基)在催化剂上相互作用得到CO2和H的氧化还原机理和羧基机理如图所示:若仅从第一步来看,(填“氧化还原机理”或“羧基机理”)对合成更有利,但最终选择另一反应机理途径的原因是。⑤在一定温度下,向2L刚性容器中充入1molCO2和3molH2,初始压强为3.2MPa,5min后体系达到平衡状态,此时容器中含有0.5molCH3OH和0.3molCO,则5min时,H2O的浓度是mol·L-1,反应Ⅰ的平衡常数Kp为。答案(1)AB(2)①低温②-41.47③增大CO2浓度④羧基机理氧化还原机理中第二步活化能更低⑤0.41.81(MPa)-24.(2023届山西大同一调,17)随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用备受关注。Ⅰ.以CO2和NH3为原料合成尿素的反应如下:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)ΔH=-87kJ/mol。研究发现,合成尿素的反应分两步完成,其能量变化如图甲所示:第一步:2NH3(g)+CO2(g)H2NCOONH4(s)ΔH1第二步:H2NCOONH4(s)CO(NH2)2(s)+H2O(g)ΔH2(1)图中ΔE=kJ/mol。(2)反应速率较快的是反应(填“第一步”或“第二步”),理由是。图甲Ⅱ.以CO2和CH4催化重整制备合成气:CO2(g)+CH4(g)2CO(g)+2H2(g)。在密闭容器中通入物质的量均为0.2mol的CH4和CO2在一定条件下发生反应,CH4的平衡转化率随温度、压强的变化关系如图乙所示。图乙(3)由图乙可知,压强p1p2(...