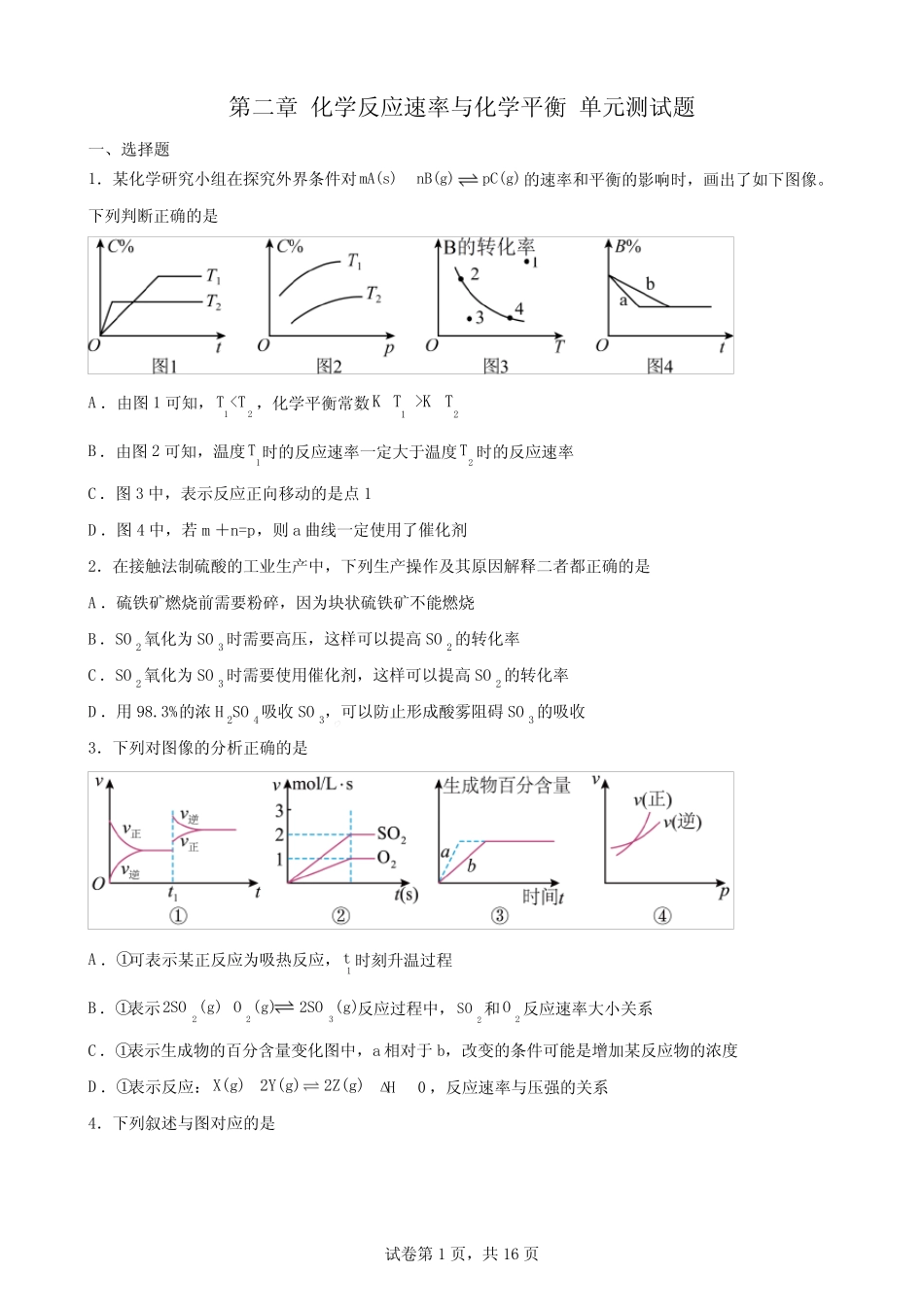
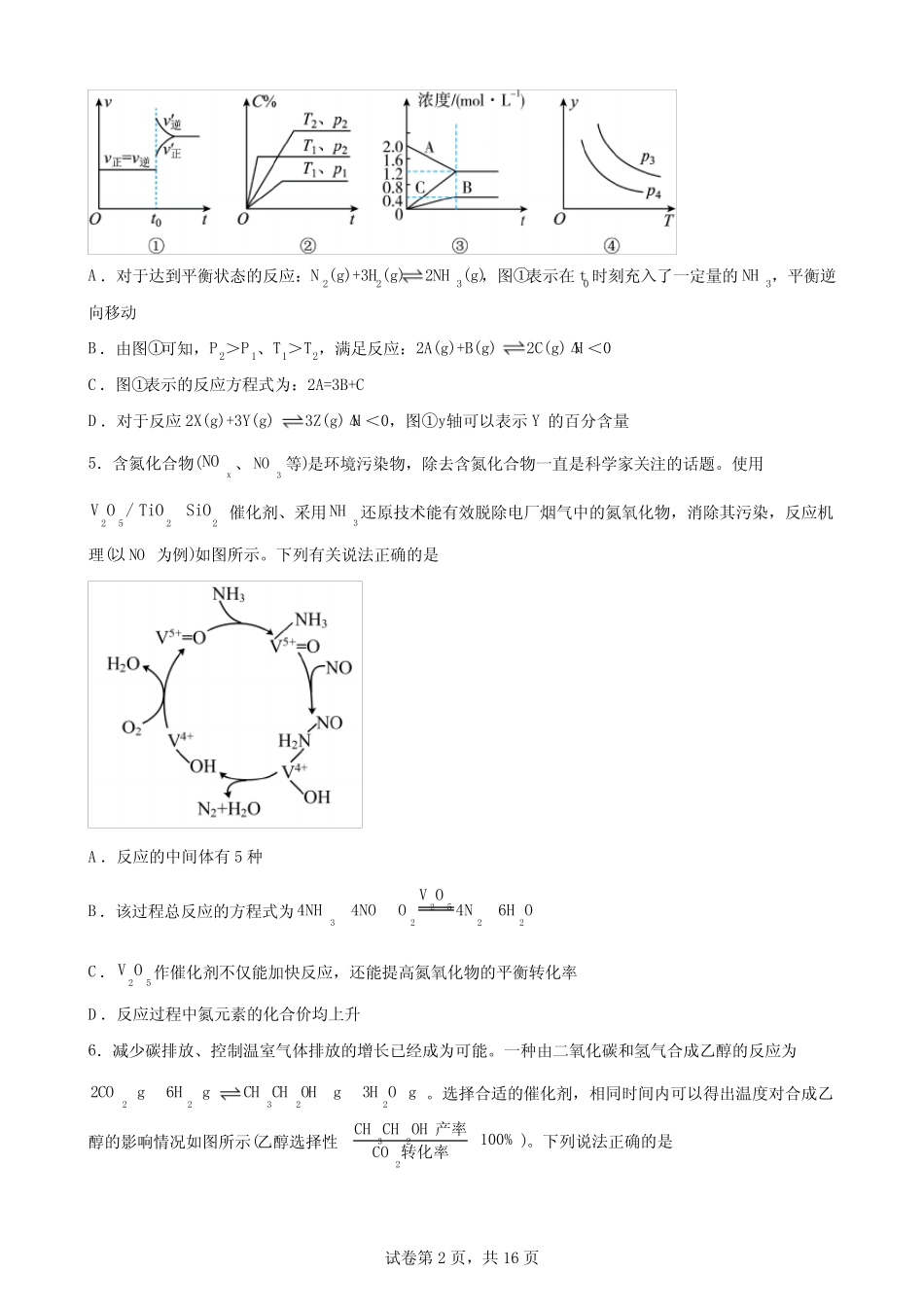
试卷第1页,共16页第二章化学反应速率与化学平衡单元测试题一、选择题1.某化学研究小组在探究外界条件对mA(s)nB(g)pC(g)的速率和平衡的影响时,画出了如下图像。下列判断正确的是A.由图1可知,12TKTB.由图2可知,温度1T时的反应速率一定大于温度2T时的反应速率C.图3中,表示反应正向移动的是点1D.图4中,若m+n=p,则a曲线一定使用了催化剂2.在接触法制硫酸的工业生产中,下列生产操作及其原因解释二者都正确的是A.硫铁矿燃烧前需要粉碎,因为块状硫铁矿不能燃烧B.SO2氧化为SO3时需要高压,这样可以提高SO2的转化率C.SO2氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率D.用98.3%的浓H2SO4吸收SO3,可以防止形成酸雾阻碍SO3的吸收3.下列对图像的分析正确的是A.①可表示某正反应为吸热反应,1t时刻升温过程B.①表示2232SO(g)O(g)2SO(g)反应过程中,2SO和2O反应速率大小关系C.①表示生成物的百分含量变化图中,a相对于b,改变的条件可能是增加某反应物的浓度D.①表示反应:X(g)2Y(g)2Z(g)Δ0H,反应速率与压强的关系4.下列叙述与图对应的是试卷第2页,共16页A.对于达到平衡状态的反应:N2(g)+3H2(g)2NH3(g),图①表示在t0时刻充入了一定量的NH3,平衡逆向移动B.由图①可知,P2>P1、T1>T2,满足反应:2A(g)+B(g)2C(g)ΔH<0C.图①表示的反应方程式为:2A=3B+CD.对于反应2X(g)+3Y(g)3Z(g)ΔH<0,图①y轴可以表示Y的百分含量5.含氮化合物(NOx、3NO等)是环境污染物,除去含氮化合物一直是科学家关注的话题。使用2522VO/TiOSiO催化剂、采用3NH还原技术能有效脱除电厂烟气中的氮氧化物,消除其污染,反应机理(以NO为例)如图所示。下列有关说法正确的是A.反应的中间体有5种B.该过程总反应的方程式为253222VO4NH4NOO4N6HOC.25VO作催化剂不仅能加快反应,还能提高氮氧化物的平衡转化率D.反应过程中氮元素的化合价均上升6.减少碳排放、控制温室气体排放的增长已经成为可能。一种由二氧化碳和氢气合成乙醇的反应为223222COg6HgCHCHOHg3HOg。选择合适的催化剂,相同时间内可以得出温度对合成乙醇的影响情况如图所示(乙醇选择性322CHCHOH100%CO产率转化率)。下列说法正确的是试卷第3页,共16页A.该反应的H0B.增大压强和升高温度都能提高2CO的平衡转化率C.温度为0T时,乙醇的产率为57.4%D.01T~T温度下,随温度升高,乙醇的产率降低7.在2L密闭恒容容器内,500①时发生反应:222NO(g)O(g)2NO(g),体系中n(NO)随时间的变化如表:时间/s01234n(NO)/mol0.0200.0100.0080.0070.007下列说法正确的是A.2s内消耗氧气的平均速率为3.0×10-3mol/(L·s)B.反应达到平衡时,2v(NO)=v(O2)C.当容器内气体的密度或气体颜色不再发生变化时,该反应达到平衡状态D.若K500℃>K550℃,第4s后升温至达到新平衡过程中逆反应速率先增大后减小(K表示平衡常数)8.4282NHSO溶液和KI溶液发生反应为222824SO2II2SO,速率方程为n2-m-28v=kcSOcI[k为速率常数,只与温度、催化剂有关,与浓度无关。n、m为反应级数,m+n为反应总级数]。实验表明,该反应很慢,加入2Fe反应速率增大且反应前后2Fe浓度保持不变。已知:228SO中存在一个过氧键,具有强氧化性。实验数据如下:实验2128SO/molLc1I/molLc反应速率①0.100.10v试卷第4页,共16页①0.100.202v①0.200.408v下列叙述错误的是A.加入2Fe,第一步离子反应为2232284SOFeFe2SOB.增大228SO浓度可以加快反应速率C.根据实验数据得知上述反应的速率方程中,m=1、n=1,总反应为2级反应D.升高温度(或加入2Fe),速率常数k都增大9.对可逆反应3224NHg5Og4NOg6HOg,下列叙述正确的是A.化学反应速率关系是:322υ(NH)=3υ(HO)B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态C.达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大D.达到化学平衡时,24υO=)(5υO)(N正逆10.已知:Ag3Bg4CgH0,向一...