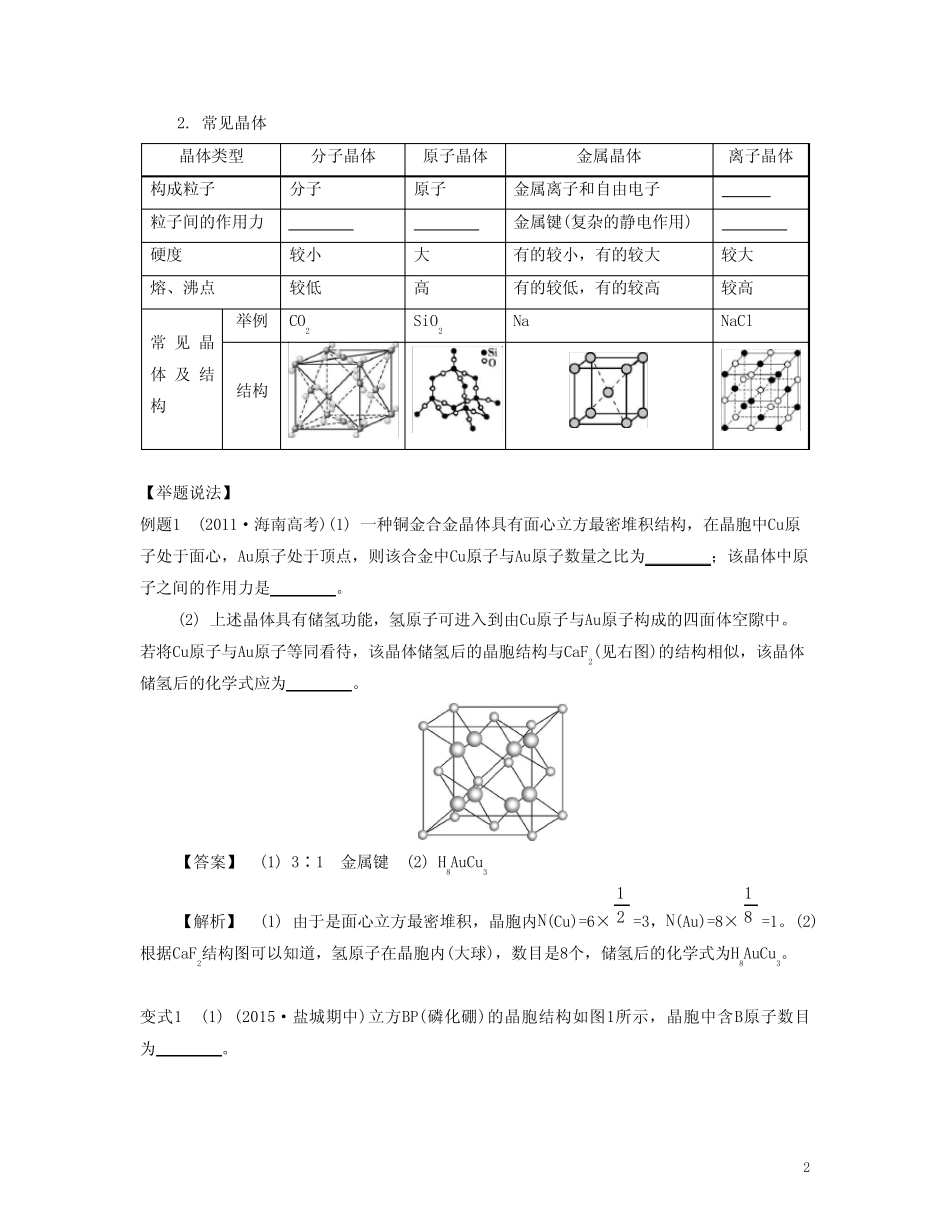
1课时35晶体结构与性质(本课时对应学生用书第158~161页)【课时导航】复习目标1.了解NaCl型和CsCl型离子晶体的结构特征,能用晶格能解释典型离子化合物的某些物理性质。2.了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。3.能用金属键的自由电子理论解释金属的某些物理性质。4.知道金属晶体的基本堆积方式,了解常见金属晶体的晶胞结构特征。5.知道分子晶体的含义,了解分子间作用力的大小对物质某些物理性质的影响。6.了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。知识网络问题思考问题1准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,通过什么方法可以区别晶体、准晶体和非晶体?问题2NaCl、CsCl、金属晶体、金刚石、干冰晶体的配位数是多少?【自主学习】考点1常见晶体与晶体类型的判断【基础梳理】1.晶胞:是描述晶体结构的基本单元,晶胞是从晶体中“截取”出来具有代表性的重复单位。晶胞在晶体中的排列呈“无隙并置”。22.常见晶体晶体类型分子晶体原子晶体金属晶体离子晶体构成粒子分子原子金属离子和自由电子粒子间的作用力金属键(复杂的静电作用)硬度较小大有的较小,有的较大较大熔、沸点较低高有的较低,有的较高较高常见晶体及结构举例CO2SiO2NaNaCl结构【举题说法】例题1(2011·海南高考)(1)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中Cu原子处于面心,Au原子处于顶点,则该合金中Cu原子与Au原子数量之比为;该晶体中原子之间的作用力是。(2)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(见右图)的结构相似,该晶体储氢后的化学式应为。【答案】(1)3∶1金属键(2)H8AuCu3【解析】(1)由于是面心立方最密堆积,晶胞内N(Cu)=6×12=3,N(Au)=8×18=1。(2)根据CaF2结构图可以知道,氢原子在晶胞内(大球),数目是8个,储氢后的化学式为H8AuCu3。变式1(1)(2015·盐城期中)立方BP(磷化硼)的晶胞结构如图1所示,晶胞中含B原子数目为。3图1图2(2)(2015·徐州期中)科学家把C60和K掺杂在一起制造出的化合物具有超导性能,其晶胞如图2所示。该化合物中的K原子和C60分子的个数比为。(3)(2015·南京调研)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为,δ、α两种晶胞中铁原子的配位数之比为。【答案】(1)4(2)3∶1(3)44∶3【解析】(1)晶胞中B原子位于顶点和面心,数目为8×18+6×12=4。(2)晶胞中K原子数目=2×6×12=6、C60分子数目=1+8×18=2,故晶胞中K原子、C60分子数目之比为3∶1。(3)利用均摊法计算得γ晶体晶胞中所含有的铁原子数为8×18+6×12=4;根据晶胞的结构可知,δ晶胞中以顶点铁原子为例,与之距离最近的铁原子是体心上的铁原子,这样的原子有8个,所以铁原子的配位数为8,α晶胞中以顶点铁原子为例,与之距离最近的铁原子是与之相连的顶点上的铁原子,这样的原子有6个,所以铁原子的配位数为6,所以δ、α两种晶胞中铁原子的配位数之比为4∶3。晶胞中微粒数的计算方法——均摊法如某个粒子为N个晶胞所共有,则该粒子有1N属于这个晶胞。中学中常见的晶胞为立方晶胞,立方晶胞中微粒数的计算方法如下:4考点2离子键与典型的离子晶体【基础梳理】1.离子键:阴、阳离子通过形成的化学键。2.离子键的强弱可以用晶格能的大小来衡量,晶格能是指拆开1mol离子晶体使之形成气态阴离子和阳离子所吸收的能量。离子所带电荷数越大、离子半径越小的离子晶体的晶格能越。晶格能越,离子晶体的熔点越、硬度越。3.离子晶体:由离子通过结合而成的晶体。4.典型的离子晶体有两种结构:NaCl型和CsCl型。氯化钠晶体中,每个钠离子周围有个氯离子,每个氯离子周围有个钠离子,每个氯化钠晶胞中含有个钠离子和个氯离子;氯化铯晶体中,每个铯离子周围有个氯离子,每个氯离子周围有个铯离子,每个氯化铯晶胞中含有个铯离子和个氯离子。NaCl型晶体CsCl型晶体每个Na+被6个Cl-所包围,同样,每个Cl-也被6个Na+所包围每个Cs+被8个Cl-所包围,同样,每个Cl-也被8个Cs+所包围55.物理性质:一般地说,离子晶...