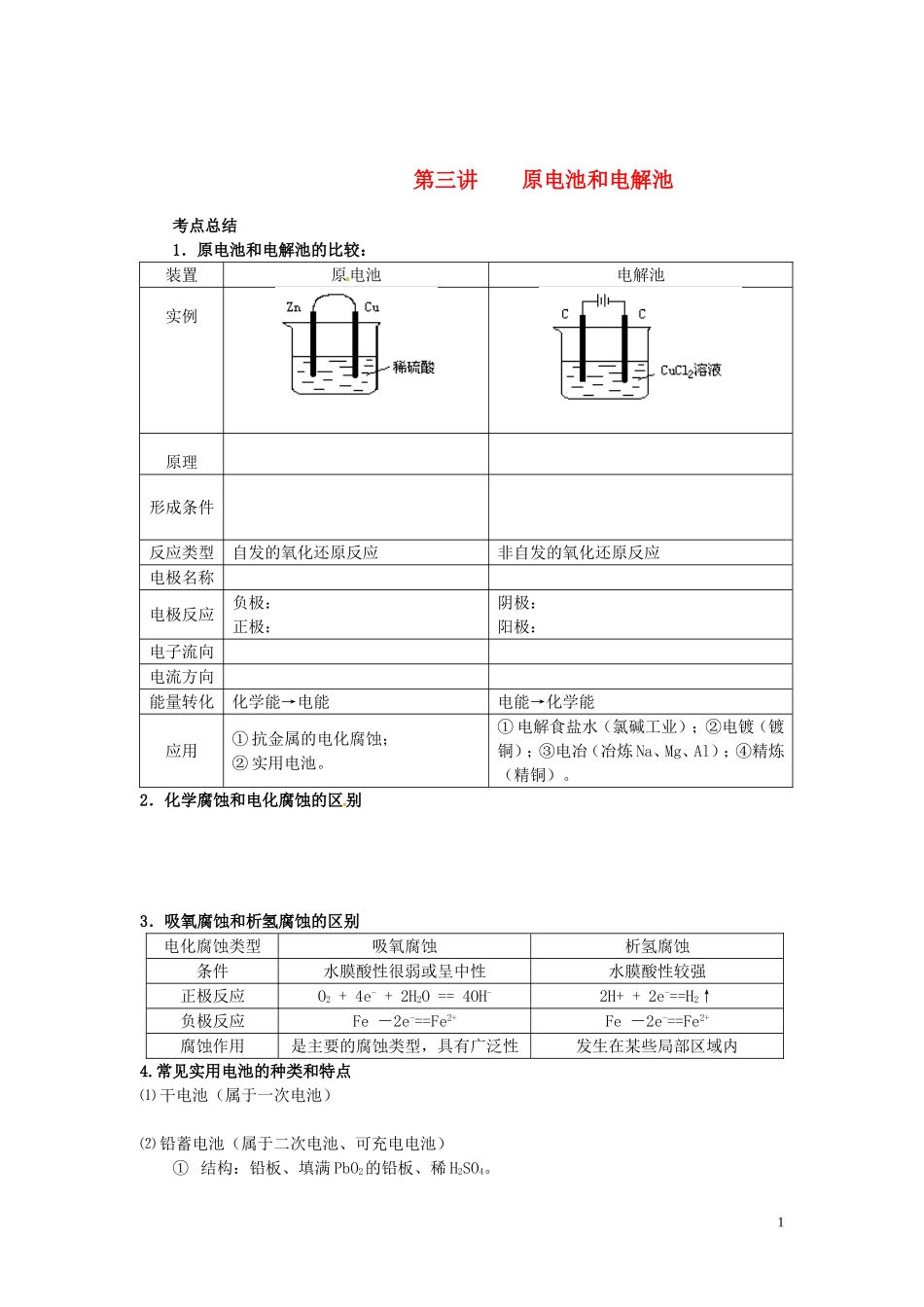
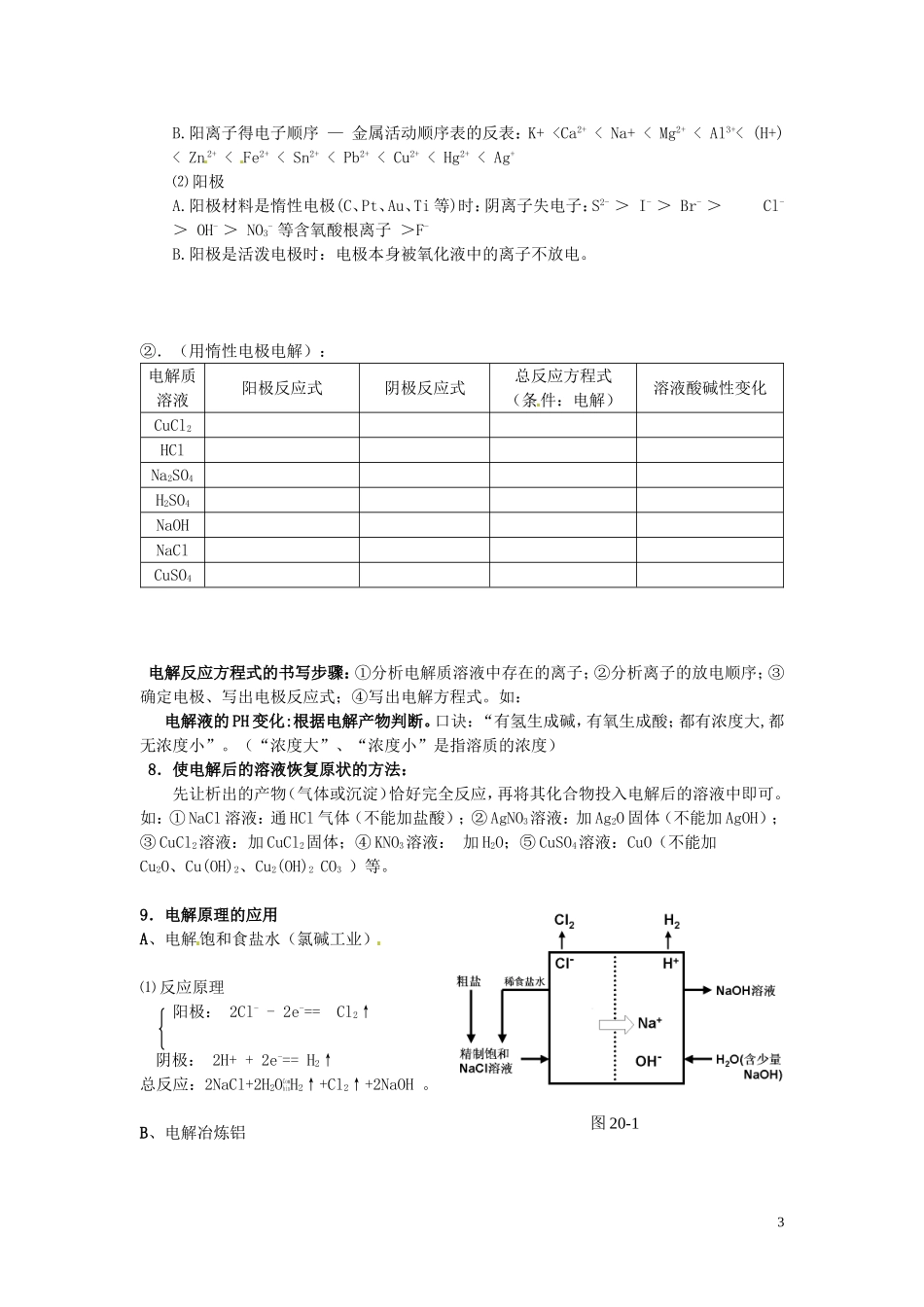
第三讲原电池和电解池考点总结1.原电池和电解池的比较:装置原电池电解池实例原理形成条件反应类型自发的氧化还原反应非自发的氧化还原反应电极名称电极反应负极:正极:阴极:阳极:电子流向电流方向能量转化化学能→电能电能→化学能应用①抗金属的电化腐蚀;②实用电池。①电解食盐水(氯碱工业);②电镀(镀铜);③电冶(冶炼Na、Mg、Al);④精炼(精铜)。2.化学腐蚀和电化腐蚀的区别3.吸氧腐蚀和析氢腐蚀的区别电化腐蚀类型吸氧腐蚀析氢腐蚀条件水膜酸性很弱或呈中性水膜酸性较强正极反应O2+4e-+2H2O==4OH-2H++2e-==H2↑负极反应Fe-2e-==Fe2+Fe-2e-==Fe2+腐蚀作用是主要的腐蚀类型,具有广泛性发生在某些局部区域内4.常见实用电池的种类和特点⑴干电池(属于一次电池)⑵铅蓄电池(属于二次电池、可充电电池)①结构:铅板、填满PbO2的铅板、稀H2SO4。1②A.放电反应负极:Pb-2e-+SO42-=PbSO4正极:PbO2+2e-+4H++SO42-=PbSO4+2H2OB.充电反应阴极:PbSO4+2e-=Pb+SO42-阳极:PbSO4-2e-+2H2O=PbO2+4H++SO42-总式:Pb+PbO2+2H2SO42PbSO4+2H2O(3)A.氢氧燃料电池①结构:石墨、石墨、KOH溶液。②电极反应负极:H2-2e-+2OH-=2H2O正极:O2+4e-+2H2O=4OH-总式:2H2+O2=2H2O其他燃烧电池:5.电解、电离和电镀的区别电解电离电镀条件受直流电作用受热或水分子作用受直流电作用实质阴阳离子定向移动,在两极发生氧化还原反应阴阳离子自由移动,无明显的化学变化用电解的方法在金属表面镀上一层金属或合金实例CuCl2CombinCu+Cl2CuCl2==Cu2++2Clˉ阳极Cu-2e-=Cu2+阴极Cu2++2e-=Cu关系先电离后电解,电镀是电解的应用6.电镀铜、精炼铜比较电镀铜精炼铜形成条件镀层金属作阳极,镀件作阴极,电镀液必须含有镀层金属的离子粗铜金属作阳极,精铜作阴极,CuSO4溶液作电解液电极反应阳极Cu-2e-=Cu2+阴极Cu2++2e-=Cu阳极:Zn-2e-=Zn2+Cu-2e-=Cu2+等阴极:Cu2++2e-=Cu溶液变化电镀液的浓度不变溶液中溶质浓度减小7.电解方程式的实例①.电解反应中反应物的判断——放电顺序⑴阴极A.阴极材料(金属或石墨)总是受到保护。2B.阳离子得电子顺序—金属活动顺序表的反表:K+