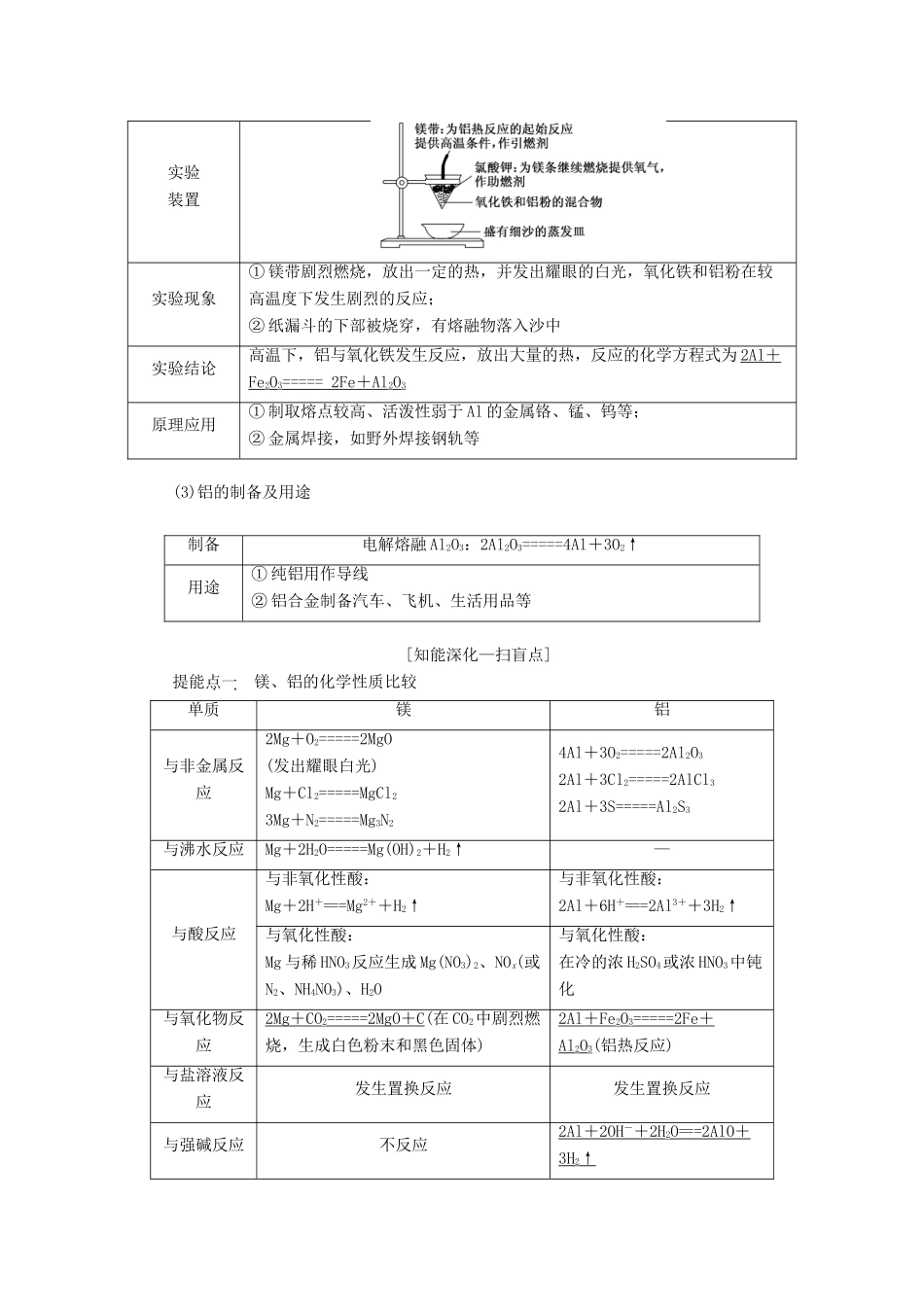
从铝土矿到铝合金镁[江苏考纲要求]—————————————————————————————————————1.理解并能应用常见金属的活动顺序。2.了解常见金属铝及其重要化合物的主要性质和重要应用。3.认识化学在金属矿物等自然资源综合利用和实现物质间转化等方面的实际应用。4.了解金属材料在生产和生活中的重要应用。认识常见无机物在生产中的应用和对生态环境的影响。[教材基础—自热身]1.铝的物理性质(1)位置与地位铝元素处在周期表中第三周期第ⅢA族,在地壳中含量仅次于硅,是地壳中含量最多的金属元素,在自然界中以化合态存在。(2)物理性质色态密度质地银白色,有金属光泽固体较小较软2.掌握铝的化学性质与用途(1)铝的化学性质铝的原子结构示意图为,其最外层有3个电子,决定了其金属性相对活泼,能与非金属、酸等发生反应。与非金属反应(O2、Cl2)与O2反应与Cl2反应:2Al+3Cl2=====2AlCl3与酸反应常温下,Al与浓硫酸、浓硝酸发生钝化,而遇稀的强氧化性稀HNO3:Al+NO+4H+===Al3++NO↑+2H2O非氧化性酸(盐酸或稀H2SO4):2Al+6H+===2Al3++3H2↑与强碱反应(NaOH)2Al+2OH-+2H2O===2AlO+3H2↑与氧化物反应(Fe2O3)2Al+Fe2O3=====2Fe+Al2O3(铝热反应)(2)铝热反应镁、铝的性质及应用实验装置实验现象①镁带剧烈燃烧,放出一定的热,并发出耀眼的白光,氧化铁和铝粉在较高温度下发生剧烈的反应;②纸漏斗的下部被烧穿,有熔融物落入沙中实验结论高温下,铝与氧化铁发生反应,放出大量的热,反应的化学方程式为2Al+Fe2O3=====2Fe+Al2O3原理应用①制取熔点较高、活泼性弱于Al的金属铬、锰、钨等;②金属焊接,如野外焊接钢轨等(3)铝的制备及用途制备电解熔融Al2O3:2Al2O3=====4Al+3O2↑用途①纯铝用作导线②铝合金制备汽车、飞机、生活用品等[知能深化—扫盲点]提能点一镁、铝的化学性质比较单质镁铝与非金属反应2Mg+O2=====2MgO(发出耀眼白光)Mg+Cl2=====MgCl23Mg+N2=====Mg3N24Al+3O2=====2Al2O32Al+3Cl2=====2AlCl32Al+3S=====Al2S3与沸水反应Mg+2H2O=====Mg(OH)2+H2↑—与酸反应与非氧化性酸:Mg+2H+===Mg2++H2↑与非氧化性酸:2Al+6H+===2Al3++3H2↑与氧化性酸:Mg与稀HNO3反应生成Mg(NO3)2、NOx(或N2、NH4NO3)、H2O与氧化性酸:在冷的浓H2SO4或浓HNO3中钝化与氧化物反应2Mg+CO2=====2MgO+C(在CO2中剧烈燃烧,生成白色粉末和黑色固体)2Al+Fe2O3=====2Fe+Al2O3(铝热反应)与盐溶液反应发生置换反应发生置换反应与强碱反应不反应2Al+2OH-+2H2O===2AlO+3H2↑[注意](1)镁、铝都是较活泼的金属,也都具有抗腐蚀的性能,原因是其在常温下能与氧气反应生成一层致密的氧化物薄膜而防止内部金属的继续氧化(会使金属失去光泽)。(2)Al与MgO不发生铝热反应;Mg能与CO2反应,因此Mg着火不能用CO2灭火。提能点二铝与酸、碱反应生成H2的量的关系铝分别与盐酸、NaOH溶液反应的化学方程式为2Al+6HCl===2AlCl3+3H2↑2Al+2NaOH+2H2O===2NaAlO2+3H2↑从化学方程式可以看出,Al与酸、碱反应时生成H2的实质是:Al―――→Al,所以不论是Al与酸还是与碱反应,Al与产生的H2的关系均是2Al~3H2。(1)等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气的体积比为=。(2)足量的铝分别与等物质的量的盐酸和氢氧化钠溶液反应,产生氢气的体积比为=。(3)一定量的铝分别和一定量的盐酸和氢氧化钠溶液反应,当产生氢气的体积比为<<,则必定是①铝与盐酸反应时,铝过量而盐酸不足;②铝与氢氧化钠溶液反应时,铝不足而氢氧化钠过量。[对点练]甲、乙两烧杯中各盛有100mL3mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成气体体积之比为1∶2,则加入的铝粉的质量为()A.5.4gB.3.6gC.2.7gD.1.8g解析:选A由2Al+6HCl===2AlCl3+3H2↑,2Al+2NaOH+2H2O===2NaAlO2+3H2↑可知,两份等质量的Al都完全反应时,生成H2的量相等,消耗HCl与NaOH的量不相等。题中已知HCl、NaOH的物质的量均为0.3mol,且生成H2的体积之比为1∶2,所以实际发生反应时的情况为HCl的量不足,Al过量;NaOH过量,Al的量不足。由生...