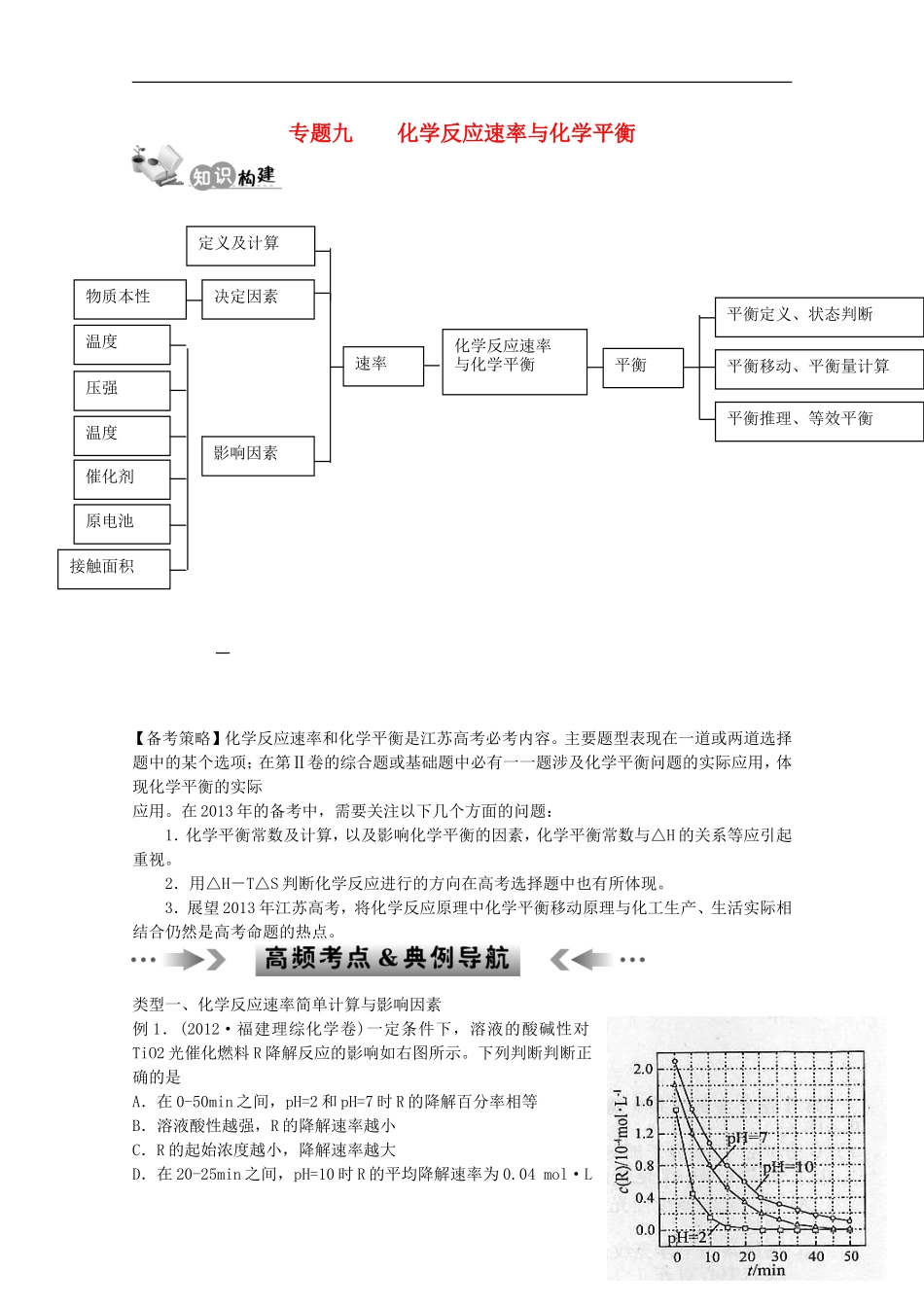
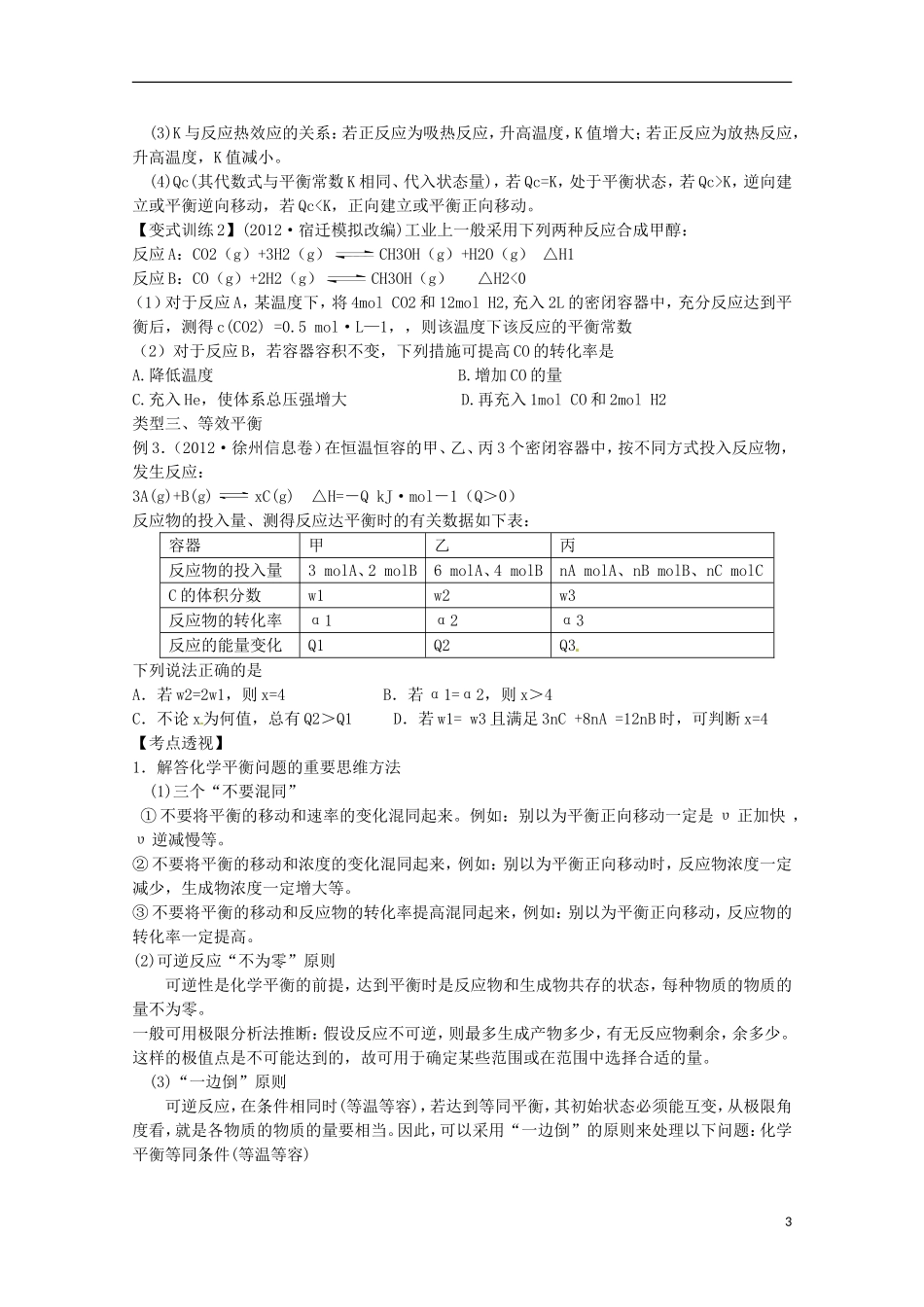
专题九化学反应速率与化学平衡【备考策略】化学反应速率和化学平衡是江苏高考必考内容。主要题型表现在一道或两道选择题中的某个选项;在第Ⅱ卷的综合题或基础题中必有一一题涉及化学平衡问题的实际应用,体现化学平衡的实际应用。在2013年的备考中,需要关注以下几个方面的问题:1.化学平衡常数及计算,以及影响化学平衡的因素,化学平衡常数与△H的关系等应引起重视。2.用△H-T△S判断化学反应进行的方向在高考选择题中也有所体现。3.展望2013年江苏高考,将化学反应原理中化学平衡移动原理与化工生产、生活实际相结合仍然是高考命题的热点。类型一、化学反应速率简单计算与影响因素例1.(2012·福建理综化学卷)一定条件下,溶液的酸碱性对TiO2光催化燃料R降解反应的影响如右图所示。下列判断判断正确的是A.在0-50min之间,pH=2和pH=7时R的降解百分率相等B.溶液酸性越强,R的降解速率越小C.R的起始浓度越小,降解速率越大D.在20-25min之间,pH=10时R的平均降解速率为0.04mol·L1化学反应速率与化学平衡速率影响因素决定因素物质本性温度压强温度催化剂原电池接触面积定义及计算平衡定义、状态判断平衡移动、平衡量计算平衡推理、等效平衡平衡—1·min—1【考点透视】1.对于化学反应速率,其考查点通常有三个方面:①依据化学反应速率的定义进行有关计算,其模式是灵活运用“υ=△c/△t”;②是同一化学反应的速率以不同物质的浓度变化表示时,各速率值之间的关系及化学方程式的确定;③是考查外界条件对反应速率的影响,其模式是依据浓度、温度、压强、催化剂、接触面积以及形成原电池等因素对化学反应速率的影响进行分析判断。2.涉及外界条件对速率的影响时,影响最大的是催化剂;其次是温度,温度越高,速率越快;然后是浓度和压强。若是可逆反应,外界条件对υ正和υ逆的影响趋势是一样的。即若升温或增大压强(有气体参与体系),υ正、υ逆均加快;若增大反应物浓度,瞬时速率υ逆不变。但最终υ正和υ逆均加快。【变式训练1】(2011·浙江高考有删减)已知:NH2COONH4+2H2ONH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。t(min)c(NH2COO-)(mol/L)¡ñ¡ñ¡ñ¡ñ¡ñ25¡æ15¡æ5¡æ¡ö¡ö¡ö¡ö¡ö¡ø¡ø¡ø¡ø¡ø(1)计算25℃时,0~6min氨基甲酸铵水解反应的平均速率___________________________。(2)根据图中信息,如何说明水解反应速率随温度升高而增大:_______________________。类型二、化学平衡状态与化学平衡移动例2.(2012·南通二模改编)CH4和H2O(g)在催化剂表面发生反应CH4+H2OCO+3H2,该反应在不同温度下的化学平衡常数如下表:温度/℃800100012001400平衡常数0.451.92276.51771.5(1)该反应是_____反应(填“吸热”或“放热”);(2)T℃时,向1L密闭容器中投入1molCH4和1molH2O(g),平衡时c(CH4)=0.5mol·L—1,该温度下反应CH4+H2OCO+3H2的平衡常数K=。(3)T℃时,向1L密闭容器中投入2mol1molCH4、1molH2O(g)、1molCO、2molH2,则反应的正反应速率逆反应速率(选填“<”“>”或“=”)。【特别提醒】(1)K只受温度影响,与反应物或生成物的浓度变化无关。(2)K值越大,说明平衡体系中生成物所占的比例越大,它的正反应进行的程度越大,即反应进行得越完全,反应物转化率越大;反之,就越不完全,转化率越小。2(3)K与反应热效应的关系:若正反应为吸热反应,升高温度,K值增大;若正反应为放热反应,升高温度,K值减小。(4)Qc(其代数式与平衡常数K相同、代入状态量),若Qc=K,处于平衡状态,若Qc>K,逆向建立或平衡逆向移动,若Qc