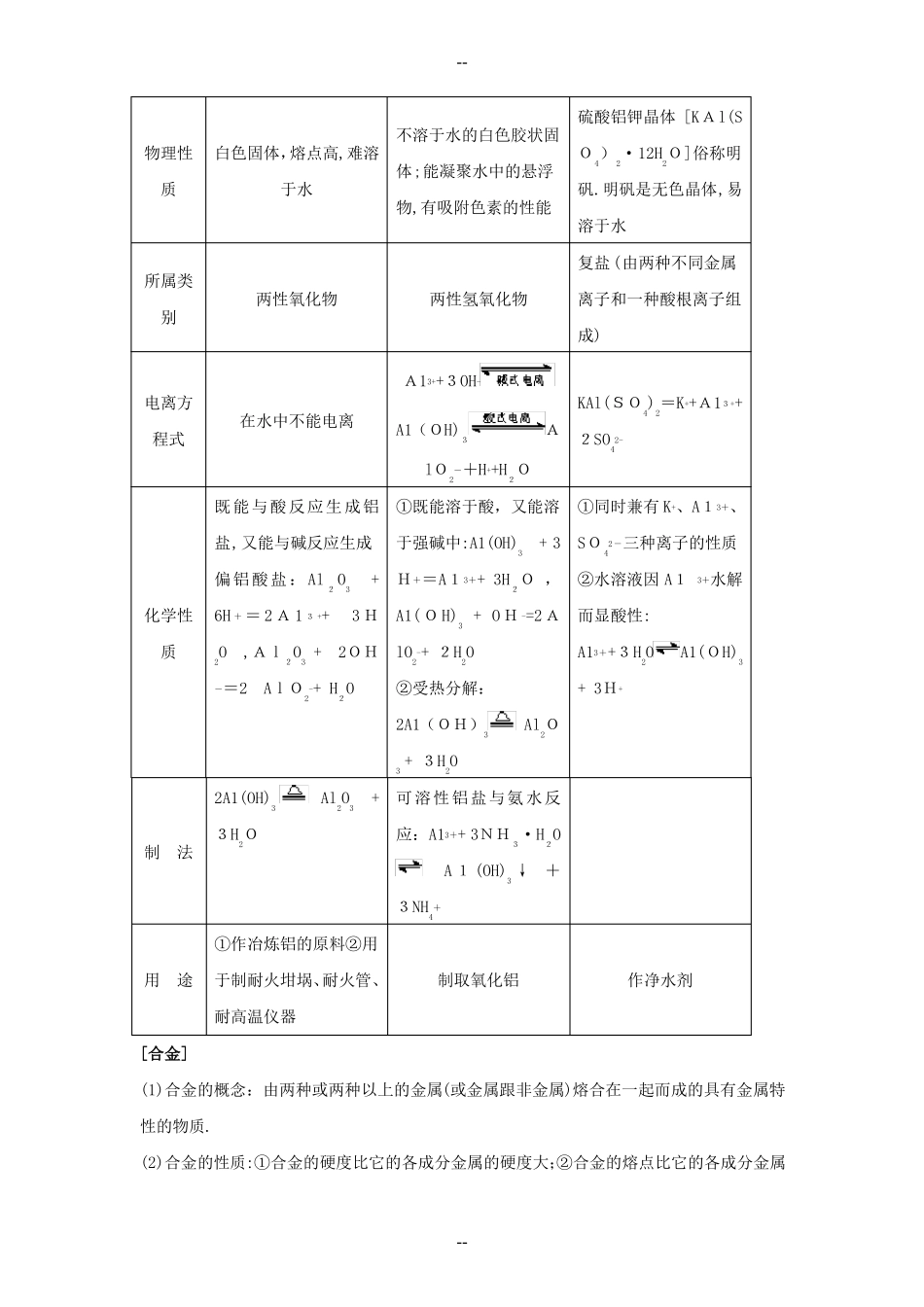
--高中化学重要金属知识点规律大全1.金属的物理性质(1)状态:在常温下,除汞(Hg)外,其余金属都是固体.(2)颜色:大多数金属呈银白色,而金、铜、铋具有特殊颜色.金属都是不透明的,整块金属具有金属光泽,但当金属处于粉末状时,常显不同颜色.(3)密度:金属的密度相差很大,常见金属如钾,钠、钙、镁、铝均为轻金属(密度小于4.5g·cm-3),密度最大的金属是铂,高达21.45g·cm.-3(4)硬度:金属的硬度差别很大,如钠、钾的硬度很小,可用小刀切割;最硬的金属是铬.(5)熔点:金属的熔点差别很大,如熔点最高的金属为钨,其熔点为3410℃,而熔点最低的金属为汞,其熔点为-38.9℃,比冰的熔点还低.(6)大多数金属都具有延展性,可以被抽成丝或压成薄片.其中延展性最好的是金.⑺金属都是电和热的良导体.其中银和铜的传热、导电性能最好.2.镁和铝[镁和铝]元素在元素周期表中的第二周期ⅡA族位置单质物理性质颜色和状态硬度密度g·c镁(1.738)<铝(2.70)m熔点/℃沸点/℃镁(645)<铝(660.4)沸点(1090)<铝(2467)均以化合态形式存在用于制作导线、电缆;铝箔用用途用于制造合金于食品、饮料的包装;用于制造合金-3镁(12Mg)铝(13Al)第三周期ⅢA族银白色固体银白色固体镁(很软)<铝(较硬)自然界存在形式----[镁与铝元素的原子结构及单质化学性质的比较]元素最外层电子数原原子半径子失电子能力、结还原性及金属构性Mg、Al均能与空气中的O2反应,生成一层坚固而致密的氧化与O2的反单质的与酸化学性质与氧化物的反应2Mg+CO22MgO+C(金属镁能在CO2气体中燃烧)2A1+Fe2O3A12O3[铝热反应]说明铝与比铝不活泼的金属氧化物(如CuO等)都可以发生铝热反应[铝的重要化合物]硫酸铝钾[KAl(SO4)氧化铝(A12O3)氢氧化铝[A1(OH)3]2镁(Mg)2个(较少)r(Mg)>r(A1)铝(A1)3个(较多)Mg>A1常温物保护膜.所以,金属镁和铝都有抗腐蚀性能2Mg+O2(空气)点燃2MgO4Al+3O2(纯)O3MgSMgCl22Al+3S2Al+3Cl2+应2A12与S、X2等非金属的反应非氧化Mg+SMg+C12A12S32AlCl33+例2A1+6H=2A1例Mg+2H=Mg+2++H2↑+3H2↑铝在冷的浓HNO3、浓H2SO4中因发生钝化而难溶2A1+2NaOH+2H2O=性酸氧化性例4Mg+10HNO3(极稀)=4Mg(NO3)2+N2O↑+5H2O不反应的反应酸与碱的反应2NaAlO2+3H2↑2Fe+]----硫酸铝钾晶体[KAl(S不溶于水的白色胶状固物理性质白色固体,熔点高,难溶体;能凝聚水中的悬浮于水物,有吸附色素的性能溶于水复盐(由两种不同金属所属类两性氧化物别成)A1+3OH电离方在水中不能电离程式A1(OH)3lO2+H+H2O既能与酸反应生成铝盐,又能与碱反应生成①既能溶于酸,又能溶于强碱中:A1(OH)3+3+3+-+3+-O4)2·12H2O]俗称明矾.明矾是无色晶体,易两性氢氧化物离子和一种酸根离子组KAl(SO4)2=K+A1+A2SO42-+3+①同时兼有K、A1、SO4三种离子的性质②水溶液因A1而显酸性:A1+3H2O+3H+3+3+2-+3+偏铝酸盐:Al2O3+H=A1+3H2O,化学性质6H=2A12+3+水解+3HA1(OH)3+OH=2AlO2+2H2O②受热分解:2A1(OH)33--O,Al2O3+2OH=2AlO2+H2O-A1(OH)3-Al2O+3H2O2A1(OH)33H2O制法Al2O3+可溶性铝盐与氨水反应:A1+3NH3·H2O3+A1(OH)3↓+3NH4①作冶炼铝的原料②用用途于制耐火坩埚、耐火管、耐高温仪器[合金](1)合金的概念:由两种或两种以上的金属(或金属跟非金属)熔合在一起而成的具有金属特性的物质.(2)合金的性质:①合金的硬度比它的各成分金属的硬度大;②合金的熔点比它的各成分金属制取氧化铝作净水剂+----的熔点低.*[硬水及其软化](1)基本概念.①硬水和软水:硬水:含有较多的Ca和Mg2+2+的水.2+软水:不含或只含少量Ca和Mg的水.②暂时硬度和永久硬度:暂时硬度:由碳酸氢钙或碳酸氢镁所引起的水的硬度.永久硬度:由钙和镁的硫酸盐或氯化物等引起的水的硬度.③暂时硬水和永久硬水:暂时硬水:含有暂时硬度的水.永久硬水:含有永久硬度的水.(2)硬水的软化方法:①煮沸法.这种方法只适用于除去暂时硬度,有关反应的化学方程式为:Ca(HCO3)2Mg(HCO3)2MgCO3+H2OCaCO3↓+CO2↑+H2OMgCO3↓+CO2↑+H2OMg(OH...