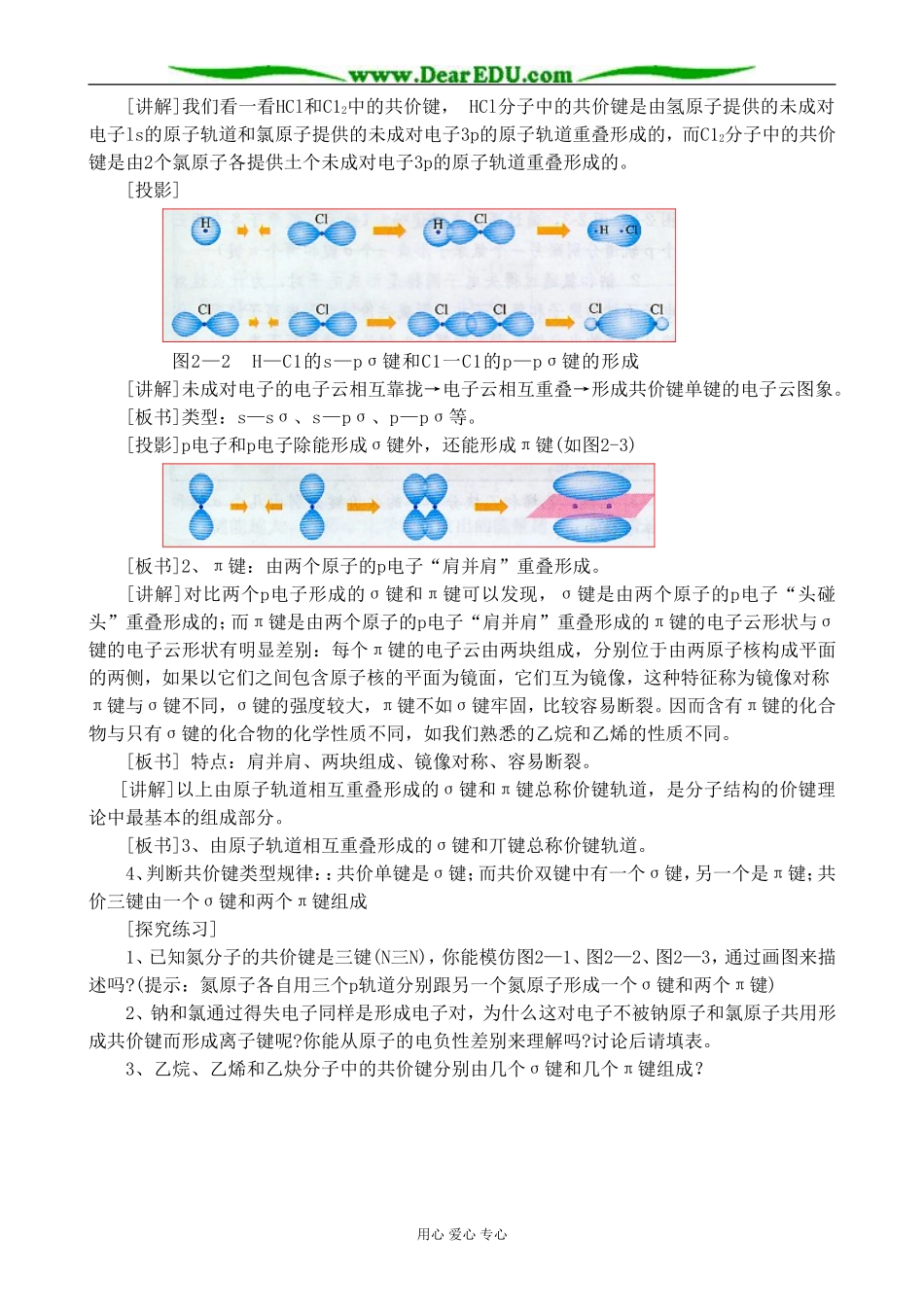
共价键教学目标:1.知道共价键的主要类型σ键和π键,能用键能、键长、键角等键参数判断简单分子的构型和稳定性。2.进一步形成有关物质结构的基本观念,初步认识物质的结构与性质之间的关系;教学重点:知道共价键的主要类型σ键和π键。教学难点:能用键能、键长、键角等键参数判断简单分子的构型和稳定性。探究建议:1、阅读与交流:配位化学的发展及其对现代化学的贡献。2、查阅N2、CO的有关数据,讨论其物理性质与结构的关系。课时划分:两课时。教学过程:第一课时[复习]1、必修中学过共价键概念。2、原子轨道、电子云概念。[过渡]通过已学过的知识,我们知道元素原子形成共价键时,共用电子对,因为电子在核外一定空间运动,所以电子云要发生重叠,它们又是通过怎样方式重叠,形成共价键的呢?[板书]第二章分子结构与性质第一节共价键[练习]共价键是常见化学键之一,它的本质是在原子之间形成共用电子对你能用电子式表示H2、HCl、C12分子的形成过程吗?(爬黑板)[评价]表扬与纠错。[讲述]按共价键的共用电子对理论,不可能有H3。、H2Cl和Cl3分子,这表明共价键具有饱和性。我们学过电子云和原子轨道。如何用电子云和原子轨道的概念来进一步理解共价键呢用电子云描述氢原子形成氢分子的过程如图2—l所示[板书]一、共价键[复习共价键的饱和性。[投影][讲解]两个1s1相互靠拢→电子云相互重叠→形成H2分子的共价键H-H。电子云在两个原子核间重叠,意味着电子出现在核间的概率增大,电子带负电,因而可以形象地说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。[板书]1、σ键:以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云的图形不变,这种特征称为轴对称。如H-H键。[设问]H2分子里的σ键是由两个s电子重叠形成的,可称为“s—sσ键”。s电子和p电子,p电子和p电子重叠是否也能形成σ键呢?用心爱心专心[讲解]我们看一看HCl和C12中的共价键,HCl分子中的共价键是由氢原子提供的未成对电子ls的原子轨道和氯原子提供的未成对电子3p的原子轨道重叠形成的,而C12分子中的共价键是由2个氯原子各提供土个未成对电子3p的原子轨道重叠形成的。[投影]图2—2H—C1的s—pσ键和C1一C1的p—pσ键的形成[讲解]未成对电子的电子云相互靠拢→电子云相互重叠→形成共价键单键的电子云图象。[板书]类型:s—sσ、s—pσ、p—pσ等。[投影]p电子和p电子除能形成σ键外,还能形成π键(如图2-3)[板书]2、π键:由两个原子的p电子“肩并肩”重叠形成。[讲解]对比两个p电子形成的σ键和π键可以发现,σ键是由两个原子的p电子“头碰头”重叠形成的;而π键是由两个原子的p电子“肩并肩”重叠形成的π键的电子云形状与σ键的电子云形状有明显差别:每个π键的电子云由两块组成,分别位于由两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像,这种特征称为镜像对称π键与σ键不同,σ键的强度较大,π键不如σ键牢固,比较容易断裂。因而含有π键的化合物与只有σ键的化合物的化学性质不同,如我们熟悉的乙烷和乙烯的性质不同。[板书]特点:肩并肩、两块组成、镜像对称、容易断裂。[讲解]以上由原子轨道相互重叠形成的σ键和π键总称价键轨道,是分子结构的价键理论中最基本的组成部分。[板书]3、由原子轨道相互重叠形成的σ键和丌键总称价键轨道。4、判断共价键类型规律::共价单键是σ键;而共价双键中有一个σ键,另一个是π键;共价三键由一个σ键和两个π键组成[探究练习]1、已知氮分子的共价键是三键(N三N),你能模仿图2—1、图2—2、图2—3,通过画图来描述吗?(提示:氮原子各自用三个p轨道分别跟另一个氮原子形成一个σ键和两个π键)2、钠和氯通过得失电子同样是形成电子对,为什么这对电子不被钠原子和氯原子共用形成共价键而形成离子键呢?你能从原子的电负性差别来理解吗?讨论后请填表。3、乙烷、乙烯和乙炔分子中的共价键分别由几个σ键和几个π键组成?用心爱心专心[交流汇报]1、2、3、乙烷:7个σ键乙烯:5个σ键一个π键乙炔:3个σ键两个π键[小结]略。[课堂练习]1、下列说法正确的是A、含有共价键的化合物一...