课题9离子晶体学习目标:1、知道晶格能的概念,了解晶格能的大小与离子键的牢固性、离子晶体熔点的高低和硬度大小的关系;2、晶格能的概念,离子晶体中离子的配位数。学习过程:【板书】二、离子晶体1、定义:离子间通过离子键结合而成的晶体。注意:无单个分子存在;NaCl不表示分子式。性质:熔沸点较高,硬度较大,难挥发难压缩,水溶液或者熔融状态下均导电。包括:强碱、部分金属氧化物、绝大部分盐。2、离子键的强度——晶格能(1)键能【讲解】以NaCl为例:键能:1mol气态NaCl分子,离解成气体原子时,所吸收的能量。用Ei表示。(2)晶格能(符号为U):拆开1mol离子晶体使之形成气态阴离子和阳离子所吸收的能量。【讲解】例如:拆开1molNaCl晶体使之形成气态钠离子和氯离子时,吸收的能量。用U表示。NaCl(s)Na+(g)+Cl—(g)U=786KJ·mol—1晶格能U越大,表明离子晶体中的离子键越牢固。键能和晶格能,均能表示离子键的强度,而且大小关系一致。通常晶格能比较常用。【设问】根据P40页表3—2讨论:晶格能与离子化合物的物理性质的关系【板书】晶格能越大,离子晶体中的离子键越牢固。一般而言,晶格能越大,离子晶体的熔沸点越高,硬度越大。【设问】分析离子键的强弱与离子半径、离子电荷有什么关系?【板书】(3)影响晶格能大小(即离子键强弱)的因素是离子的电荷和离子半径。规律:离子带电荷数越多,离子半径越小则晶格能越大,离子键越强,离子晶体熔点越高。【小结】离子电荷数越大,核间距越小,晶格能越大,离子键越牢,离子晶体的熔、沸点越高,硬度越大。【练习】1.比较下列离子化合物的熔点NaF>NaCl>NaBrNaF
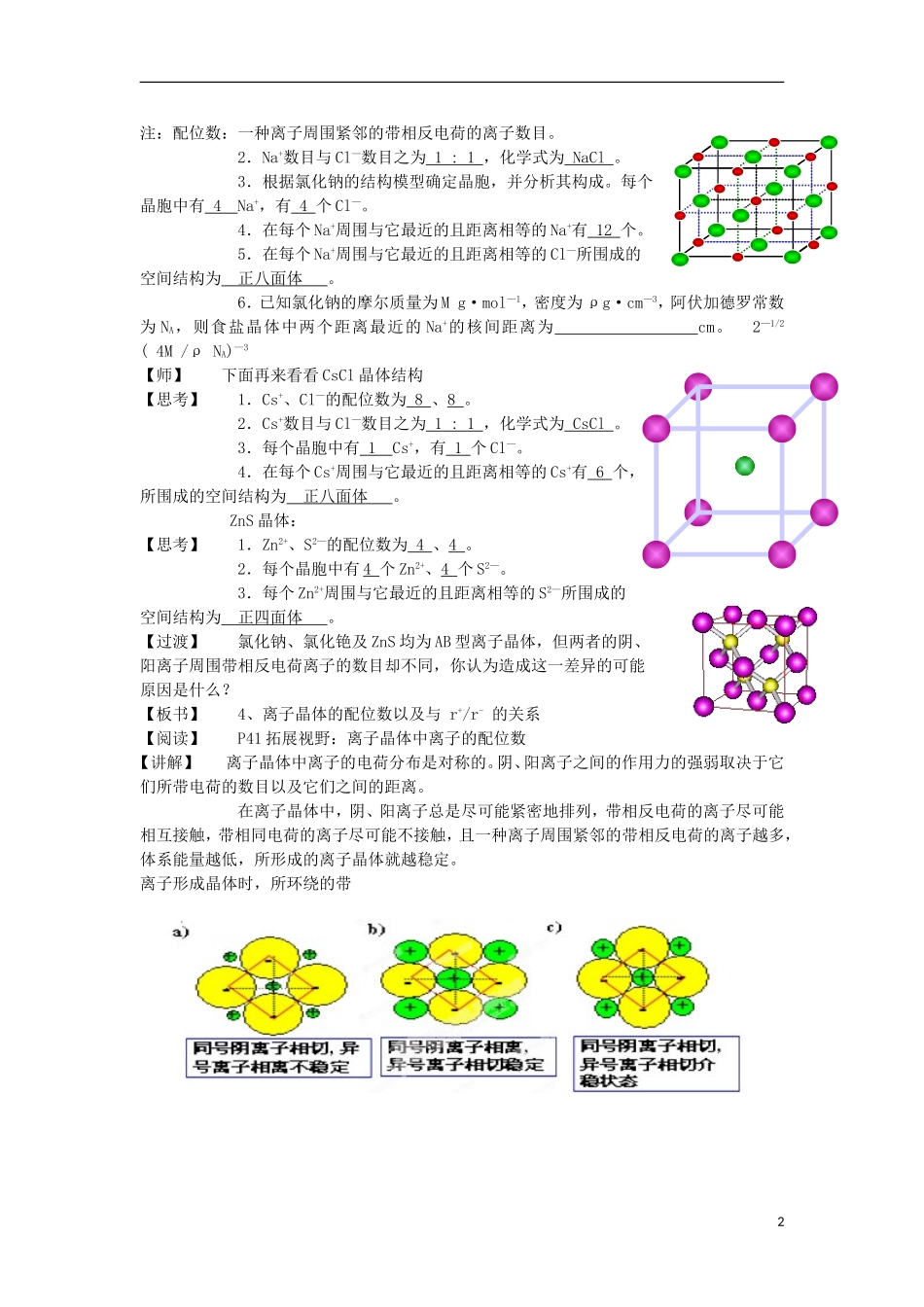
K2O(2)MgCl2CsBr【过渡】大多数离子化合物在常温下以晶体的形式存在。离子晶体也有一定的空间结构。【板书】3、离子晶体的空间结构【讲解】离子晶体有多种晶体结构类型,其中氯化钠型和氯化铯型是两种最常见的离子晶体结构类型。首先看NaCl的晶胞。【思考】1.每个Na+同时吸引6个Cl—,每个Cl—同时吸引6个Na+,即Na+、Cl—的配位数为6、6。1注:配位数:一种离子周围紧邻的带相反电荷的离子数目。2.Na+数目与Cl—数目之为1:1,化学式为NaCl。3.根据氯化钠的结构模型确定晶胞,并分析其构成。每个晶胞中有4Na+,有4个Cl—。4.在每个Na+周围与它最近的且距离相等的Na+有12个。5.在每个Na+周围与它最近的且距离相等的Cl—所围成的空间结构为正八面体。6.已知氯化钠的摩尔质量为Mg·mol—1,密度为ρg·cm—3,阿伏加德罗常数为NA,则食盐晶体中两个距离最近的Na+的核间距离为cm。2—1/2(4M/ρNA)—3【师】下面再来看看CsCl晶体结构【思考】1.Cs+、Cl—的配位数为8、8。2.Cs+数目与Cl—数目之为1:1,化学式为CsCl。3.每个晶胞中有1Cs+,有1个Cl—。4.在每个Cs+周围与它最近的且距离相等的Cs+有6个,所围成的空间结构为正八面体。ZnS晶体:【思考】1.Zn2+、S2—的配位数为4、4。2.每个晶胞中有4个Zn2+、4个S2—。3.每个Zn2+周围与它最近的且距离相等的S2—所围成的空间结构为正四面体。【过渡】氯化钠、氯化铯及ZnS均为AB型离子晶体,但两者的阴、阳离子周围带相反电荷离子的数目却不同,你认为造成这一差异的可能原因是什么?【板书】4、离子晶体的配位数以及与r+/r-的关系【阅读】P41拓展视野:离子晶体中离子的配位数【讲解】离子晶体中离子的电荷分布是对称的。阴、阳离子之间的作用力的强弱取决于它们所带电荷的数目以及它们之间的距离。在离子晶体中,阴、阳离子总是尽可能紧密地排列,带相反电荷的离子尽可能相互接触,带相同电荷的离子尽可能不接触,且一种离子周围紧邻的带相反电荷的离子越多,体系能量越低,所形成的离子晶体就越稳定。离子形成晶体时,所环绕的带2【讲解】离子晶体中一种离子周围所环绕的带相反电荷的离子的数目的多少,与阴、阳离子半径比r+/r—有关。从六配位的介稳状态出发,进行半径比与配位数之间关系的探讨:此时,为介稳状态。如果r+再大些,则出现上述b)种情况,即阴离子同号相离,异号相切的稳定状态。亦即当r+继续增加,达到并超过:时,即...