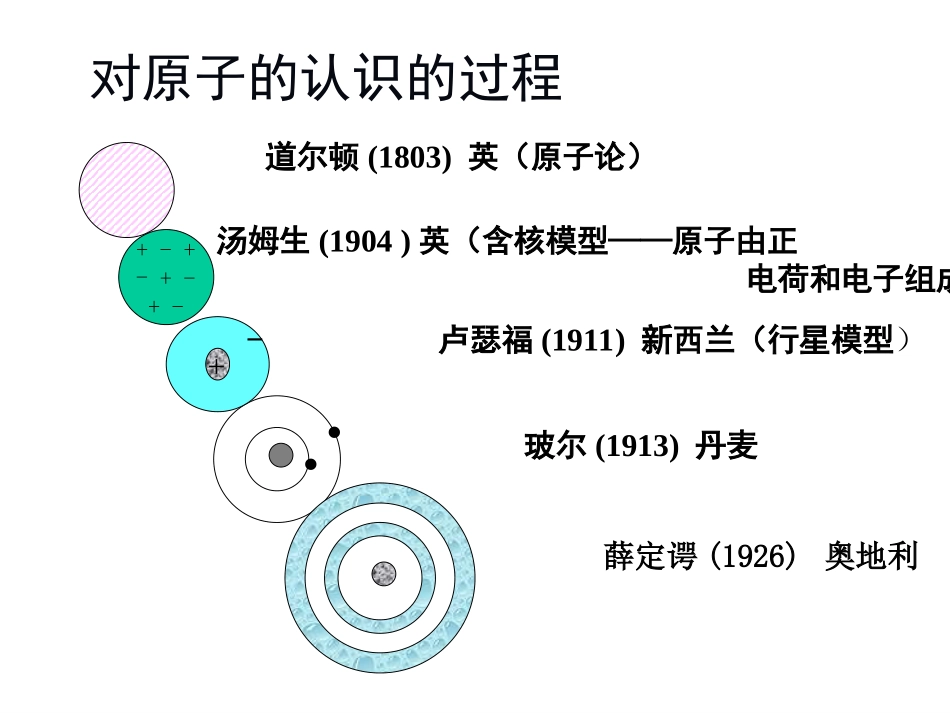
第十章原子结构和元素周期律10.1原子结构的早期模型10.2微观粒子的波粒二象性10.3现代原子结构模型—氢原子核外电子的运动状态10.4原子结构和元素周期系10.5元素的性质与原子结构的关系10.1原子结构的早期模型10.1.1原子的含核模型10.1.2原子的玻尔模型对原子的认识的过程+-+-+-+-••道尔顿(1803)英(原子论)汤姆生(1904)英(含核模型——原子由正电荷和电子组成)+卢瑟福(1911)新西兰(行星模型)-玻尔(1913)丹麦薛定谔(1926)奥地利10.1.1原子的含核模型发现电子后,实验又证实了各种物质都有可能放出电子,同时整个原子又是电中性的,因此原子中除电子以外,必定还有另一带正电荷的组成部分。1904年汤姆生提出了一种原子模型,认为原子中平均分布着正电荷,在正电荷中镶嵌着许多电子,从而形成了中性原子。汤姆生的原子模型只是有关原子结构的原始的、相当模糊的概念。卢瑟福α粒子散射实验卢瑟福的行星模型英国物理学家卢瑟福根据α粒子散射的实验,建立了原子结构的行星模型。他认为原子的中心有一个带正电的原子核,电子在它的周围旋转,由于原子核和电子在整个原子中只占有很小的空间,因此原子中绝大部分是空的。卢瑟福行星模型遇到的困难1、根据经典理论,电子绕原子核运动时要幅射电磁波,因而电子的能量不断减少,电子运动的速度也不断减慢,电子运动的轨道半径也将相应地变小并逐渐靠近原子核,最后落到核上,电子湮灭,原子将不复存在。2、电子运动过程中幅射电磁波的波长也是连续变化的,应得到连续光谱。但事实上原子是稳定的,原子光谱是线状光谱。10.1.2原子的玻尔模型太阳光通过三棱镜折射后,可分出红、橙、黄、绿、青、兰、紫等波长的光谱,光的强度随频度变化呈连续分布的光谱称连续光谱。原子光谱当气体原子受激发后,也会发出光线,通过三棱镜或光栅后,可分成一系列按波长排列的亮线,这种光谱是线状光谱。因为是原子受激发而产生的,故称为原子光谱。不同的原子有不同的特征光谱,氢原子光谱是最简单的原子光谱。抽掉放电管中空气,再充入少量氢气。氢原子可见光区光谱Rydberg常数:17Hm100967761~.R2)121(~1~2222H,nnRλνBalmer(瑞士)提出氢光谱谱线公式:HHHHH656.3486.1434.1410.2390/nm对氢原子光谱的进一步研究,发现:122221H)11(~1~n,nnnRλν氢原子光谱玻尔原子模型1913年,28岁的丹麦物理学家玻尔受普朗克和爱因斯坦量子论的启发,提出了新的玻尔原子模型。1.电子沿园形轨道绕核作园周运动,原子有许多轨道,轨道离核愈远,能量愈高。在轨道上运动的电子具有确定的能量,称为定态,原子有许多定态,能量最低的定态称基态,其余称激发态。处于定态的原子不幅射能量。玻尔原子模型(2)电子由一个轨道(E2)跃迁至另一个的轨道(E1)时,放出或吸收一个光子的能量h12EEhsJ10626.634hh为普朗克常量,放出光子hEE13吸收光子||13EEh氢原子光谱与轨道能级关系玻尔原子模型(3))原子中的轨道必须符合一定的条件,即在轨道上运动的电子的角动量必须满足量子化条件:,,,nnπhnM3212M2M3M玻尔H原子模型电子轨道能级基态1E2E3E4E激发态hEE123,2,1,2nnhnM1n2n3n4n用玻尔理论计算氢原子轨道半径rmv22024re20224rermv离心力与静电引力相等2hnmvrM角动量量子化条件0220eanmhnr22由上两式可得:m101pm52.9pm122200meha将各常数代入,得氢原子基态半径用玻尔理论计算氢原子能量,,,nRnhεmenE321181222042氢原子能量量子化!J106.1eV1J1018.2eV6131918.RremvEEE022π421位动氢原子光谱设n1、n2是氢原子两个轨道的量子数,能量为E1和E2222121221211)(nnRnRnREEh2221222111~111~nnRnnhcRc17183418m101.094678sm103sJ106.626J1018.2~hcRR与实验值:17Hm101.096776R~完全吻合。即Rydberg公式。玻尔理论的缺陷(1)未能完全...