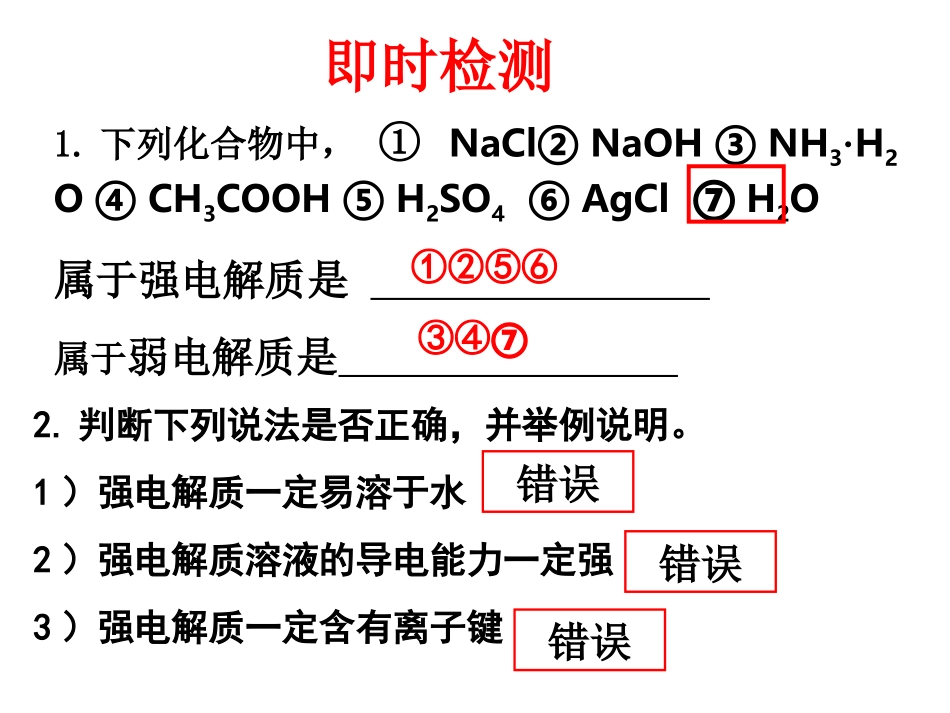
第2节水的电离和溶液的酸碱性第1课时复习巩固【问题组一】1.什么是电解质?什么是非电解质?二者的划分依据是什么?2.什么是强电解质?什么是弱电解质?二者的划分依据是什么?在水溶液中或熔化状态下能导电的化合物在水溶液中和熔化状态下都不导电的化合物在水中能够全部电离的电解质在水中只能部分电离的电解质1.下列化合物中,①NaCl②NaOH③NH3·H2O④CH3COOH⑤H2SO4⑥AgCl⑦H2O属于强电解质是属于弱电解质是①②⑤⑥③④⑦即时检测2.判断下列说法是否正确,并举例说明。1)强电解质一定易溶于水2)强电解质溶液的导电能力一定强3)强电解质一定含有离子键错误错误错误第二节水的电离和溶液的酸碱性学习目标[知识与技能]1.知道水是一种极弱的电解质,在一定的温度下,水的离子积是常数。2.学会判断溶液的酸碱性。3.了解测定溶液pH的方法,能进行pH的简单计算。[过程与方法]体会合作交流和讨论的学习方法[情感与价值]意识到自然界中各类物种之间互相依存、互相制约的关系,体会对立统一的辩证唯物主义的哲学观点。H2O+H2OH3O++OH-一、水的电离水是极弱的电解质25℃时,1L水中只有10-7molH2O分子发生电离水合氢离子简写为:H2OH++OH-(水电离出的H+、OH-浓度相等)【问题组二】1.什么是水的离子积?2.常温下水的离子积是多少?3.水的离子积受什么因素影响?结合课本,推出!结合课本,推出!自学推出!K电离=c(H+)×c(OH-)c(H2O)K.=c(H+).c(OH-)c(H2O)Kw=c(H+).c(OH-)其中常数K与常数c(H2O)的积记为Kw,称为水的离子积常数,简称为离子积H2OH++OH-1、水的离子积常数KW=c(H+)·c(OH-)=1×10-14如果温度变化,Kw会如何变化?为什么?常温下即25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/LKw100℃50℃25℃20℃0℃温度1.14×10-156.81×10-151×10-145.47×10-141×10-12电离吸热升高温度:平衡向移动c(H+),c(OH-),Kw右增大增大增大注意:水的离子积只随温度的改变而改变H2OH++OH-Kw适用于一定温度下任何稀的电解质溶液KW=c(H+)·c(OH-)常温下对纯水进行下列操作:加NaOH加HCl加热Kwc(H+)c(OH-)浓度大小关系c(OH-)c(H+)水的电离平衡移动方向酸碱性条件(2)加入酸或碱,抑制水的电离,Kw不变增大c(H+)>c(OH-)c(H+)10-7<10-7c(H+)>c(OH-)酸性NaOH左移<10-7>10-7c(H+)